美国食品药品管理局FDA正在出版一本紫皮书,列入所有获批生物类似药的信息,让更多的医生和患者更好地了解这些价廉物美的生物制品。
“不断增加的生物仿制药上市,增加了市场竞争,让患者的负担和医疗体系成本有效降低,”FDA局长Scott Gottlieb博士表示。
“通过引入生物仿制药,可能导致大量的节省,而且可能改善市场准入并促进更好的公共卫生结果。了解FDA用于评估生物仿制药的严格程序可以帮助医生和患者最大化地得到这些产品的益处。”Gottlieb在声明中说。
为了让医生和患者更好了解生物类似药,FDA正在出版生物类似药的紫皮书,列入所有获批的生物类似药。
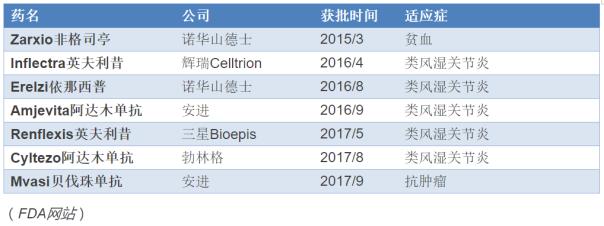
自从两年前的2015年3月,FDA批准了第一个生物类似药,诺华山德士的Zarxio, 治疗贫血的非格司亭,目前以每年三个的速度在批准生物类似药。2016年获批的三个中有依那西普和阿达木单抗,其中阿达木单抗是最畅销生物药,艾伯维(Abbvie)公司的修美乐(Humira)的生物类似药。
2017年,FDA批准了第一个抗肿瘤生物类似药,安进的贝伐珠单抗,原研药是罗氏的安维汀(Avastin)。
FDA的紫皮书列入了全部7个批准的生物类似药。它们是:
FDA药物评估和研究中心(CEBR)的新生物制剂办公室副主任Leah Christl说,“在准备教育和外联工作的材料之前,我们广泛地进行了规划和研究。通过这个过程,我们了解到医疗保健人员有哪些具体问题。”
“这些问题包括有关FDA批准生物仿制药决策的数据和信息的问题。基于这一反馈,FDA已经开发了教材,帮助医护人员更好地了解这些重要(生物类似药)产品及其所走过的审批流程。而且,这还包括为卫生保健专业人员准备的概况介绍和图示,以及用于向更多的感兴趣的患者传播信息的材料。”
这些资料包括:
提供术语的基本定义。这些术语包括:生物制品,参考产品,生物相似物,可互换;和其他术语,以便于了解生物仿制药与其参考产品之间的关系;
描述生物仿制药在批准前必须符合的严格标准。 并说明FDA批准途径和这些产品的作用机理; 和
提供关于FDA审查数据的简洁易懂的信息,如:确定生物相似性,以及如何查找更多资源。
新的紫皮书还强调了有关生物仿制药的重要参考资料。该参考文献可以帮助医生和患者了解哪些生物参考产品目前拥有FDA批准的一种或多种的生物仿制药或可互换产品。
接下来,FDA还计划开展与卫生保健专业人员的更多研究,以了解更多关于医生与患者正确沟通生物仿制药的信息类型。
FDA紫皮书网站:
https://www.fda.gov/drugs/developmentapprovalprocess/howdrugsaredevelopedandapproved/approvalapplications/therapeuticbiologicapplications/biosimilars/ucm411424.htm
