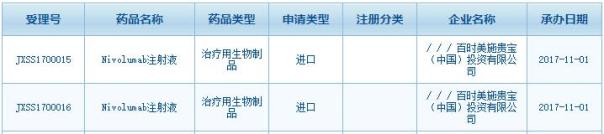
国家食品药品监督管理总局药品审评中心(CDE)公开信息显示,11月1日,百时美施贵宝(BMS)提交的PD-1单抗Opdivo(Nivolumab,诺维莫单抗)的上市销售申请(JXSS1700015,JXSS1700016)获得承办受理。这使得Opdivo成为第一款在中国提交上市申请的PD-1/PD-L1类药物。
在上市申请承办前几日,Opdivo最新临床申请(JXSL1700069)获得CDE承办受理。截至10月26日,Opdivo临床申请受理数已达12项。

Opdivo是目前最畅销的PD-1免疫检查点抑制剂,2015年销售额9.42亿美元,2016年销售额37.74亿美元,2017年前三季度销售额35.87亿美元。市场空间巨大,导致PD-1/PD-L1类药物竞争越发激烈,另外4种上市药物——默沙东Keytruda、罗氏Tecentriq、阿斯利康Imfinzi、默克/辉瑞Bavencio都在追赶Opdivo的脚步。
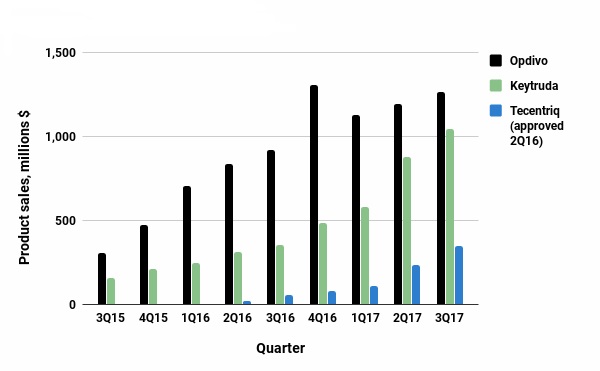
数据来源:Ned Pagliarulo / BioPharma Dive公司的数据
Opdivo最早于2014年7月在日本获得批准,成为全球首个获批上市的PD-1/PD-L1类药物。通过利用人体自身免疫系统帮助恢复抗肿瘤免疫反应,Opdivo已成为多种癌症的重要治疗方法,目前获批9个适应症包括黑色素瘤、非小细胞肺癌、肾细胞癌、经典型霍奇金淋巴瘤、头颈癌、尿路上皮癌、结直肠癌、肝细胞癌、胃癌。
至今年9月统计,BMS已在国内布局Opdivo用于多种实体瘤治疗的临床试验招募,早就在为上市做着准备。(详见文章:三家国内PD-1/PD-L1获批临床 肿瘤免疫火热 患者招募难?)期待这款重磅药能与国内广大患者早日见面。(作者:KERR)

