胃癌是全世界第五大常见恶性肿瘤,是导致癌症死亡的第三大原因。超过70%的胃癌新发病例发生在发展中国家,约50%的病例发生在亚洲东部,主要集中在中国。中国胃癌发病例数和死亡例数分别占全球胃癌发病和死亡的42.6%和45.0%,在全球183个国家中位于发病率第5位、死亡率第6位。
在精准治疗已成为趋势的今天,有很多的肿瘤靶向药物也将其适应症扩展至胃癌方向,同时也涌现出很多新的的靶向药物(例如PD-1)进入到了临床研究阶段。肿瘤靶向药物的众多靶点中,到底哪个或哪些靶点更具成功的潜力,是我们迫切想要了解的。本文就是从已有各靶向胃癌药物的临床研究出发,来看看靶向胃癌药物在各个靶点方面的成败结果及出现的问题。本文并未针对各个临床研究中的胃癌适应症进行细分统计,有意的读者可以参照文后的参考文献进行详细了解。
部分已上市和在研胃癌靶向药物

胃癌靶向药物临床数据对比
1. 表皮生长因子受体(EGFR)
EGFR或HER1是人类EGFR家族(HER1、HER2、HER3和HER4)的成员。胃癌患者中EGFR基因扩增的比例高达7.7%~27.4%。通过结合配体EGF和TGFα来激活HER1。使用免疫组织化学(IHC)和荧光原位杂交(FISH)方法来鉴定EGFR的蛋白表达。EGFR阳性已经显示出了预后价值,并预测了淋巴结转移和总体预后不良。
EGFR相关胃癌药物包括西妥昔单抗(Cetuximab)和帕尼单抗(Panitumumab),并可与全身化疗药物联合使用。然而,EGFR抑制剂在临床试验中没有表现出临床益处。这些试验中的患者可能是非选择性组群,即不是基于EGFR蛋白表达来进行分组。
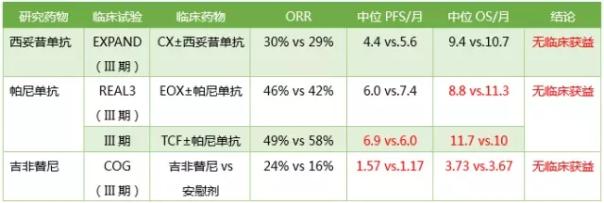
注:C:顺铂;X:卡培他滨;F:5-氟尿嘧啶;O:奥沙利铂;E:表柔比星;T:多西他赛;
2. 人表皮生长因子2(HER2/ERBB2)
HER2是EGFR家族的成员。与通过与配体结合而激活的HER1和其他家族成员不同,HER2通过与家族的其他成员形成异二聚体而发出信号。通过IHC和FISH来鉴定HER2表达,7%-38%的胃和胃食管癌患者出现HER2高表达,胃食管连接处肿瘤患者的HER2高表达比例更高。
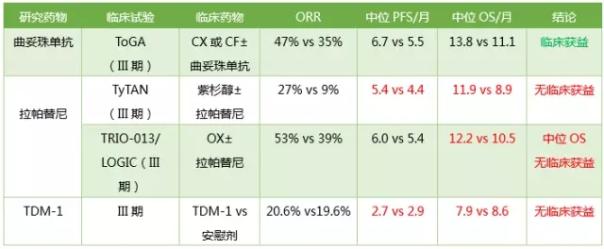
注:TDM-1:曲妥珠单抗-Emtansine偶联物
3. 血管内皮生长因子(VEGF)
胃癌与其它实体瘤一样,其生长和转移与血管形成密切相关,而血管内皮生长因子(VEGF)的促血管生长作用最强。肿瘤细胞能合成并周期性分泌VEGF,促进肿瘤新生血管形成,并能特异性促使内皮细胞增殖及直接参与血管增生。研究表明VEGF在胃癌组织中的高表达与胃癌的生长、浸润和转移密切相关。近年来,越来越多的VEGF靶向药物体现出在胃癌治疗中的应用价值。
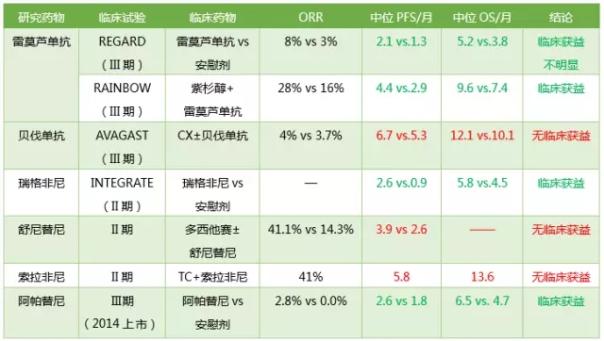
4. 雷帕霉素机制性靶标(mTOR)
雷帕霉素及其衍生物在体内主要与FKBP12形成复合物,结合到mTORC1,阻止下游S6K1和4EBP1磷酸化,从而抑制癌细胞增殖、使细胞停滞在G1期而诱导凋亡。因此mTOR信号通路与肿瘤的发生、发展密切相关,并与肿瘤的血管生成、转移以及化疗耐药有关。

5. PARP抑制
聚腺苷二磷酸核糖聚合酶(PARPs)是存在于真核细胞中的一类核酶,至少有18种亚型,其中PARP-1是最早被发现的与中风、神经退行性病变、癌症、心肌缺血和糖尿病等疾病的治疗均有应用。PARP-1与多种恶性肿瘤密切相关,在胃癌领域,目前多见PARP-1基因单核酸多态性与胃癌的相关性研究。
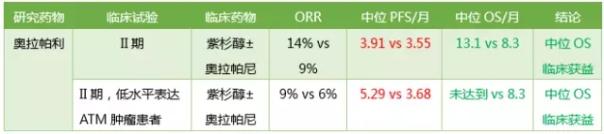
6. 免疫检查点抑制剂
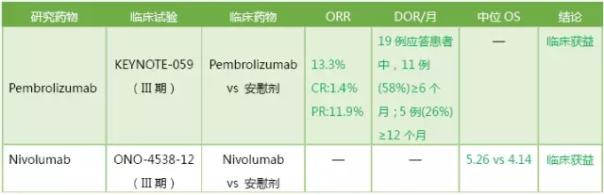
近年来,针对程序性细胞死亡蛋白1(PD-1)途径的新型免疫检查点抑制剂已证明在治疗黑色素瘤,非小细胞肺癌和肾癌中的地位。尽管某些PD-L1 +肿瘤(如肺癌,黑素瘤膀胱癌)已被证明对PD-1导向治疗更为敏感,但关于PD-L1表达和作为胃食管癌预测标志物的微卫星不稳定性(MSI)的作用只有稀疏的数据。14-24%胃癌患者的肿瘤细胞和35%患者的免疫细胞中检测到了PD-L1表达。
胃癌的不同生物学或分子亚型对PD-1阻断是否具有不同的敏感性也存在问题。鉴于MSI结肠直肠癌中观察到的结果,预测MSI亚组可能更好地响应PD-1阻断可能是合理的。也有研究观察到15%的EBV+胃癌具有编码PD-1配体PD-L1和PD-L2的基因,因此EBV +胃癌更可能受益于PD-1-导向疗法和免疫攻击。
2017年9月,FDA根据KEYNOTE-059试验结果批准了Pembrolizumab的胃癌适应症。同月,PDMA根据ONO-4538-12试验结果批准了Nivolumab的胃癌适应症。
结语
总体来说,VEGF抑制剂似乎比EGFR和HER2/ERBB2更加具有治疗胃癌的潜力。新兴的免疫检查点抑制剂也给未来的胃癌精准治疗提供了希望。更为重要的是,选择各个胃癌靶标蛋白高表达的针对性患者入组是提高临床中位PFS和OS的关键因素,这可能成为未来胃癌靶向药物临床研究的趋势。
参考文献:
Karen De Souza, Suha Atabani & Srinivasan Madhusudan (2017): Precision medicine in gastric cancer: where are we now?, Expert Review of Precision Medicine and Drug Development, DOI: 10.1080/23808993.2017.1357431
