作者:医药魔方
吉利德8月10日宣布,FDA已经授予其在研固定剂量复方艾滋病药物bictegravir/恩曲他滨/替诺福韦艾拉酚胺(BIC/FTC/TAF,50/200/25mg)治疗HIV-1感染的上市申请优先审评资格,PDUFA预定审批期限是2018/2/12日。
Gilead是在今年6月12日向FDA提交了该复方的上市申请,同时使用了一张优先审评券。Gilead手上现金充足,趁优先审评券价格回落之际果断出手抢到两张。此次花在BIC/FTC/TAF身上的优先审评券如果平均一下,成本也高达1.6亿美元左右,比起第一次使用优先审评券在三合一艾滋病药物Odefsey(FTC/利匹韦林/TAF)身上,代价又多出4000万美元。
现有优先审评券的使用情况

Odefsey去年3月上市,今年上半年便给Gilead贡献了4.85亿美元的收入,这张优先审评券也算没有白费。Gilead在艾滋病产品上不惜血本的心情是完全可以理解的,因为在丙肝业务难以避免地衰退情况下,GSK又在艾滋病市场对其发出了有力挑战。
GSK与Gilead艾滋病业务收入变化趋势
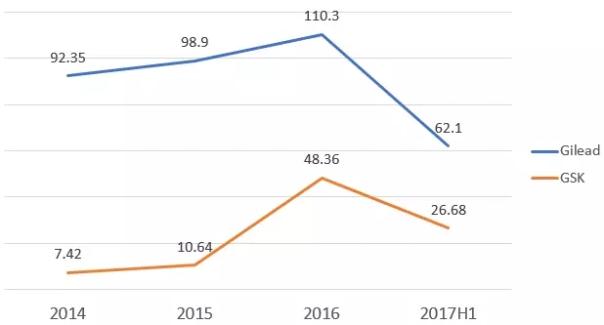
从销售收入来看,Gilead原本是躺在艾滋病市场的钱堆上睡觉,但是自从多替拉韦上市后,GSK在艾滋病市场就慢慢重新崛起,到了2016年,已经明显威胁到了Gilead的统治地位(见:葛兰素史克 VS 吉利德:两代艾滋病霸主的深情对决)。
到2017H1,虽然吉利德的3款基于TAF的艾滋病新药都表现不错(见:2017H1市场表现最好的新药TOP20),但仍难遏制GSK的快速崛起,二者的市场份额差距再度缩小。Gilead在丙肝市场已经萎缩得很厉害了,在艾滋病市场虽然仍有很好的增长,但也不像之前那样高枕无忧,因此加快了更具创新性的艾滋病药物的上市速度,把优先审评券花在了基于新型整合酶链转移抑制剂BIC开发的艾滋病复方新药身上。
在西雅图举行的2017年抗逆转录病毒和机会性感染会议(CROI)上,Gilead公布了bictegravir的首个关键II期研究结果:治疗新确诊艾滋病患者时,bictegravir+恩曲他滨+TAF(BIC/FTC/TAF)与dolutegravir+恩曲他滨+TAF(DTG/FTC/TAF)相比,在第24周和48周时病毒DNA载量小于50拷贝的患者比例更高(97% vs 94%,97% vs 91%),但无显著性差异。BIC/FTC/TAF组在第48周时无1例患者耐药,Gilead未透露DTG/FTC/TAF组是否耐药。不过Gilead期望BIC/FTC/TAF组合可以凭借更好的肾脏安全性胜出,但在II期研究中有1例患者因为荨麻疹而终止治疗,无疑让大家对正在进行的III期研究的安全性结果更为关注。
