作者: 玲珑
通化东宝发布公告称,公司于近日收到国家药监局核发的利拉鲁肽注射液的药物临床试验批件。据跨国公司财报数据,2018年上半年诺和诺德的利拉鲁肽注射液以18.23亿美元的销售额成为全球第二畅销的降糖药。据米内网数据,目前有9家企业布局利拉鲁肽生物类似药,华东医药、翰宇药业、通化东宝处于第一梯队,胰岛素产品半年营收超10亿的通化东宝有望斩获国内首个利拉鲁肽生物类似药。
利拉鲁肽为何物?全球第二热销降糖药
据各跨国公司财报数据,诺和诺德的利拉鲁肽注射液(商品名诺和力)以18.23亿美元的销售额成为全球第二畅销的降糖药。
利拉鲁肽是一种人胰高糖素样肽-1(GLP-1)类似物,GLP-1具有血糖依赖性促进胰岛素分泌、保护胰岛β细胞、延迟胃排空降低食欲等生理功能,是近几年来新兴且热门的糖尿病治疗新靶点,成为糖尿病市场扩容的最大动力。
图1:2013-2017年诺和诺德利拉鲁肽国内外销售情况
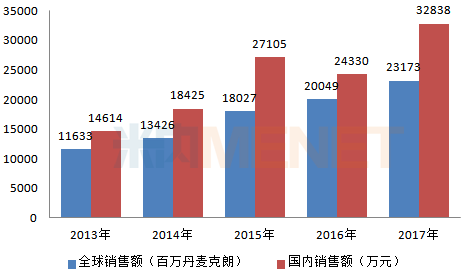
注:国内销售额为中国公立医疗机构终端销售额
(来源:米内网数据库)
利拉鲁肽由丹麦诺和诺德研制,于2009年7月首先在欧盟上市,2010年在美国上市。利拉鲁肽上市后就成为最畅销的GLP-1受体激动剂,据米内网跨国上市公司销售数据库显示,近几年来,利拉鲁肽全球销售额逐年看涨,2016年首次突破200亿丹麦克朗,2017年达到231.73亿丹麦克朗。此外,利拉鲁肽另一适应症也于2014年年底经FDA获批上市,成为唯一一个用于减肥的针剂,利拉鲁肽未来增量可期。
利拉鲁肽于2011年进入中国市场,2017年在中国公立医疗机构终端的销售额首次突破3亿元,可见利拉鲁肽国内市场规模并不算大,主要原因是利拉鲁肽原研药价格高,且在2017年以前没有进入医保,因此用药群体不大,但在2017年7月,利拉鲁肽通过谈判成功进入医保目录,3ml:18mg规格的价格降至410元/支,降幅约43%,这将有助于扩大利拉鲁肽国内用药群体。
从竞争格局看,目前国内还没有利拉鲁肽生物类似药获批上市,原研厂家诺和诺德独占整个市场。目前已有多家企业在布局利拉鲁肽仿制药,一旦有仿制药获批上市,将给原研药带来巨大冲击,倒逼原研药价格进一步下降,推动利拉鲁肽国内市场进一步扩容。
利拉鲁肽“首仿战”,通化东宝有望后来者居上
表1:利拉鲁肽仿制品种申报情况

(来源:米内网MED中国药品审评数据库2.0)
据米内网MED中国药品审评数据库2.0数据,截至10月19日,共有9家企业布局利拉鲁肽生物类似药的研发,其中有3家企业的产品已经获批临床,分别为杭州九源基因工程、深圳翰宇药业及通化东宝药业。
九源基因的利拉鲁肽有两个临床受理号,2014年4月承办的临床受理号是以新药10类申报,已经于2016年8月获批临床,并以近8000万元转给华东医药,推测该产品生产工艺与原研产品一致,但是由于发酵菌体不同,因此按照10类申报;2017年2月承办的临床受理号是以新药7类申报,已经于2017年9月获批临床,推测该产品是申报了新适应症,利拉鲁肽减肥的适应症已经在国外获批,但国内尚未获批,因此按7类生物药申报。
翰宇药业的利拉鲁肽于2015年8月按化药仿制药6类申报临床,并于2017年9月获批临床,推测该产品的整条多肽链都是化学合成,因此按照化药仿制药进行申报。诺和诺德的利拉鲁肽在国内是按生物药获批的,翰宇药业按6类化学药来申报利拉鲁肽,最终能否成功获批生产,目前还不好确定。
通化东宝的利拉鲁肽于2018年10月获批临床,该产品是以新药15类申报,根据《药品注册管理办法》的规定,注册分类13-15类的制品一般仅需进行III期临床试验,也就是说通化东宝的利拉鲁肽获批临床后,只需要进行III期临床试验,完成后即可申报生产,在时间上有望赶超其他两家企业。
深耕糖尿病领域,通化东宝龙头优势持续提升
据通化东宝2018年中报数据,2018年上半年公司实现营业收入14.6亿,同比增长23.85%,归母净利润5.37亿,同比增长30.78%。其中胰岛素系列产品营业收入10.85亿元,同比增长18.98%,占总营业收入的74.14%。
表2:2017年中国公立医疗机构终端通化东宝胰岛素系列产品销售情况(单位:亿元)
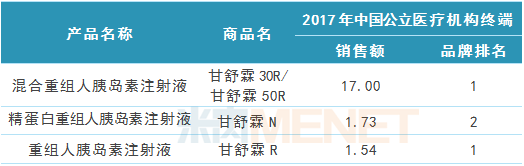
(来源:米内网中国公立医疗机构终端竞争格局)
通化东宝拥有以重组人胰岛素注射液为代表的系列产品,主要包括30/70混合重组人胰岛素注射液(商品名甘舒霖30R)、50/50混合重组人胰岛素注射液(商品名甘舒霖50R)、精蛋白重组人胰岛素注射液(商品名甘舒霖N)、重组人胰岛素注射液(商品名甘舒霖R)。
混合重组人胰岛素注射液是通化东宝的独家产品,也是公司业绩增长点。据米内网数据,通化东宝的甘舒霖30R在2017年中国公立医疗机构终端化学药糖尿病用药品牌TOP20中排名第八,在中国城市零售药店终端化学药糖尿病用药品牌TOP20中排名第十二。
表3:通化东宝糖尿病领域研发管线(部分产品)
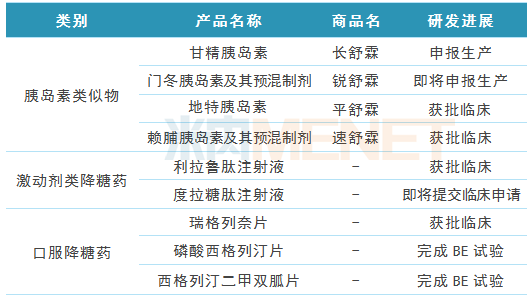
(来源:米内网数据库、上市公司中报)
在胰岛素类似物研发方面,甘精胰岛素于2014年6月获得临床试验批件,2017年10月申报生产,目前CDE已完成该品种报产材料的初步审评,并于2018年6月向公司下达补充要求,公司正在积极的准备补充材料,尽快递交;门冬胰岛素于2014年12月获得临床试验批件,现已完成数据库锁定,预计2018年年底申报生产;地特胰岛素原料药及其注射液于2017年10月取得临床试验批件,现处于临床试验筹备阶段;重组赖脯胰岛素及其预混制剂已完成临床前的药学和药理毒理评价,于2017年11月提交了临床试验申请,2018年10月获批临床。
在激动剂类降糖药研发方面,利拉鲁肽注射液已完成临床前药效、药代动力学研究和安全性评价工作,于2017年11月获得临床受理,2018年10月获批临床;度拉糖肽注射液目前正在进行临床试验申报资料的整理和撰写,计划在2018年年底前递交临床试验申请。
口服降糖药研发方面,瑞格列奈片于2016年获批临床,计划2019年通过生物等效性研究,申报生产;DPP-4抑制剂磷酸西格列汀片于2018年上半年完成生物等效性试验,预计今年10月完成注册报产;SGLT-2抑制剂恩格列净于2018年上半年完成原料药合成的工艺研究,预计下半年完成原料药放大生产研究,2019年完成所有药学研究。
来源:米内网数据库,上市公司公告
原标题:厉害了,“降糖新宠”半年卖了$18亿,首仿战已打响,“降糖龙头”或后来居上
