作者: 洪杰
2018年4月30日,港交所修订的IPO新规生效。这意味着香港正式接纳在收益、市值等方面较为弱势的新经济公司。对于生物科技公司来说,“允许未有收入或盈利的生物科技公司在港上市”的政策更是意义深远。
作为一只未盈利的生物医药类企业,复宏汉霖此番赴港IPO申请获受理,正式得益于此“新政”。
在之前的12月6日,复星医药发布公告称,分拆控股子公司上海复宏汉霖生物技术股份有限公司赴港上市的申请材料,已获得中国证监会的受理。
复宏汉霖已发行股份总数为4.74亿股,其中,复星医药全资子公司上海复星新药研究有限公司及上海复星医药产业发展有限公司合计持有复宏汉霖2.90亿股股份,约占复宏汉霖已发行股份总数的61%。
另外公告表示,复宏汉霖H股建议发售规模将不超过经扩大复宏汉霖总股本的15%。复宏汉霖此番分拆、上市后,将继续为复星医药的控股子公司。
复宏汉霖成立于2010年2月,由复星医药与海外科学家团队合资组建,主要致力于符合全球标准的生物类似药及创新型抗体药物的研发和生产。
复宏汉霖曾计划在新三板挂牌,其新三板挂牌申请于2016年12月28日获得受理。但是两年之后,结合复宏汉霖发展需要及各地资本市场特色,董事会于2018年9月27日同意复宏汉霖撤回新三板上市申请,转而投身港交所。
根据复宏汉霖的上市申请显示,复宏汉霖的研发管线包含20种以上自主开发候选生物药及多种肿瘤免疫联合疗法,其中HLX01(利妥昔单抗)已获得NMPA的上市许可优先审评并预计于2019年上市,HLX02(曲妥珠单抗)、HLX03(阿达木单抗)、HLX04(贝伐珠单抗)正在进行III期临床试验。
目前,复宏汉霖13个产品、1个联合治疗方案已完成22项适应症的临床试验申请,累计获得全球范围内27个临床试验许可(中国大陆17个,中国台湾3个,美国3个,欧盟、澳大利亚、乌克兰和菲律宾各1个)。

另外,根据药物综合数据库(PDB)显示,复宏汉霖4种接近上市的核心产品所处的样本医院市场规模不断扩大。其中,利妥昔单抗、曲妥珠单抗、贝伐珠单抗均已纳入国家医保目录,在国家不断鼓励进口替代的大环境下,预计获批后将很快放量。
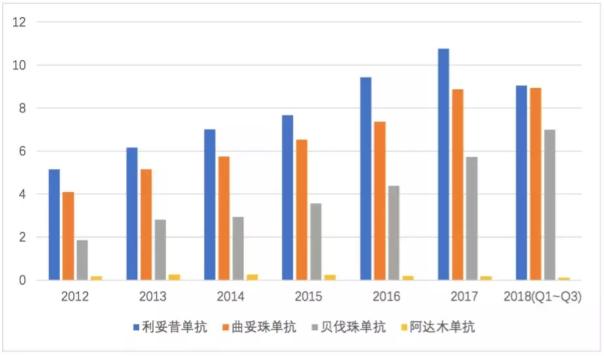
药物综合数据库(PDB)
复宏汉霖底气之生物类似物
HLX01
HLX01为美罗华(利妥昔单抗)生物类似药,名称为重组人鼠嵌合抗CD20单克隆抗体注射液。HLX01已获国家药典委员会授权在中国使用利妥昔单抗注射液的通用名,这将有助于HLX01获得国家医保的报销机会。HLX01已获得NMPA的上市许可优先审评(非霍奇金淋巴瘤)并预计于2019年上市。另外,HLX01还在同时进行HLX01类风湿性关节炎适应症的3期临床试验。
HLX02
HLX02为赫赛汀生物类似药,名为注射用重组抗人表皮生长因子受体2人源化单克隆抗体。赫赛汀(曲妥珠单抗)主要用于治疗HER2阳性早期乳腺癌及转移性乳腺癌,以及转移性胃癌。HLX02的转移性乳腺癌已进入3期临床试验且已完成入组工作。
复宏汉霖预计在2019年向NMPA提交新药上市申请,用于治疗HER2阳性早期乳腺癌、HER2阳性转移性乳腺癌及HER2阳性转移性胃癌,即赫赛汀在中国获批准的相同所有适应症。
HLX03
HLX03为修美乐的生物类似药,名称为重组抗肿瘤坏死因子α全人源单克隆抗体注射液。修美乐(阿达木单抗)主要用于治疗类风湿性关节炎、强直性脊柱炎、斑块状银屑病及克罗恩氏病。HLX03已收到类风湿性关节炎及斑块状银屑病适应症的新药临床试验申请批准,其中斑块状银屑病适应症已进入3期临床试验。计划于2019年向NMPA提交新药上市申请,用于治疗斑块状银屑病、类风湿性关节炎及强直性脊柱炎,即所有修美乐在中国获批准的相同适应症。
HLX04
HLX04为安维汀的生物类似药,名为重组抗VEGF人源化单克隆抗体。安维汀(贝伐珠单抗)主要用于治疗转移性结直肠癌及非鳞状非小细胞肺癌。HLX04正进行转移性结直肠癌适应症的3期临床试验。预计于2020年向NMPA提交新药上市申请,用于治疗转移性结直肠癌及不可切除、局部晚期、复发性或转移性非鳞状非小细胞肺癌,即安维汀在中国获批准的相同适应症。
另外,复宏汉霖同时在开发HLX04+HLX10作为主要肿瘤免疫联合疗法之一,目前已在中国开始进行1期临床试验。此外,已就湿性年龄相关黄斑变性及糖尿病性视网膜病变适应症提交临床试验申请。
其他候选生物类似药
除上述核心产品外,复宏汉霖还有多个处于较早开发阶段的其他候选生物类似药抗体:
•HLX11:Perjeta(帕妥珠单抗)生物类似药,由罗氏开发。是一种与曲妥珠单抗及多西他赛联用的抗HER2药物,用于治疗HER2阳性早期乳腺癌及转移性乳腺癌。HLX11目前正在进行临床前研究。
•HLX12: Cyramza(雷莫芦单抗)生物类似药,由礼来开发。是一种抗VEGFR2药物,用于治疗晚期胃癌、胃食管交界处腺癌、转移性非小细胞肺癌及转移性结直肠癌。HLX12已获批进行临床试验。
•HLX14: Xgeva(地诺单抗)生物类似药,Xgeva由安进开发。通过结合并抑制核因子RANK配体而发挥作用,从而治疗与骨头相关的疾病。HLX14目前正在进行临床前研究。
•HLX13: Yervoy(易普利单抗)生物类似药,由百时美施贵宝开发。是一种抗CTLA-4药物,用于治疗实体瘤。HLX13目前正进行临床前研究。
•HLX15: Darzalex(达雷木单抗)生物类似药,由强生开发。是一种抗CD38药物,用于多发性骨髓瘤。HLX15目前正进行临床前研究。
复宏汉霖底气之创新药
HLX06
HLX06为血管内皮生长因子受体2抑制剂,用于治疗实体瘤。已获得在美国、中国大陆及台湾开展HLX06的临床研究批准,且于最后实际可行日期,已在台湾开始1期临床试验。
HLX06以VEGTO2(—种刺激血管生成的信号蛋白)为靶点,并通过与其结合进行作用。VEGFR2通常介导VEGF于血管生成中的下游产生效应。由于某些肿瘤细胞释放促血管生成因子与VEGF受体作为其增殖活性的一部分,通过阻断VEGFR2,传导信号而不影鞞VEGF结合,HLX06有助于通过VEGF通路抑制肿瘤生长。通过与VEGFR2免疫球蛋白结构域5-7结合,以VEGFR2信号为靶点通路,HLX06充当VEGFR2拮抗剂。
HLX07
HLX07一种重组抗表皮生长因子受体人源化单克隆抗体,为西妥昔单抗的生物改良药。西妥昔单抗主要用于治疗转移性结直肠癌及局部晚期头颈癌,包括头颈部鳞状细胞癌。HLX07正在中国大陆进行lb/2期临床试验,并在台湾进行la期临床试验。作为生物改良药,HLX07为人源化单克隆抗体而非人鼠嵌合抗体(如西妥昔单抗),HLX07在安全性方面将优于西妥昔单抗。
HLX10
HLX10为重组抗PD-1人源化单克隆抗体,用于治疗各类实体瘤和血液肿瘤。HLX10分别于2017年9月、2017年12月及2018年3月在美国、台湾及中国大陆获得新药临床试验申请批准。已在台湾启动la期临床试验,预期于二零一九年上半年完成。
此外,HLX10与化疗、放疗或包括HLX04和HLX07在内的其他若干候选单抗药物联用时表现出显著疗效。因此,预计同时申请监管批准,将这些联合疗法推向上市。
HLX20
HLX20为PD-L1抑制剂。通过结合PD-L1生效,阻止PD-L1与PD-1的免疫抑制相互作用。于2018年7月在中国获得新药临床试验申请批准开发HLX20,并在澳大利亚开展1期临床试验。
HLX22
HLX22(—种新型HER2抑制剂),以单独使用或与部分其他候选药物联合使用,包括HLX02及HLX10。计划在临床试验中优先考虑HLX22的乳腺癌及胃癌适应症。此外,临床前研究表示HLX22与赫赛汀联用可产生协同效应,在肿瘤模型中(用于胃癌)与曲妥珠单抗单药治疗、Perjeta(帕妥珠单抗)(由罗氏开发的抗HER2药物)单药治疗及曲妥珠单抗联合帕妥珠单抗相比,显示出更好的治疗效果。
HLX55
HLX55(—种酪氨酸蛋白激酶抑制剂),以单独或连同若干其他候选药(包括HLX06)使用。计划在临床试验中将HLX55优先用于胃癌及恶性胶质瘤适应症。
HLX56
标靶死亡受体HLX56。死亡受体靶向药物的潜在适应症包括实体瘤(如转移性结直肠癌及肺癌)以及血液恶性肿瘤。
死亡受体为TNF相关凋亡诱导配体的受体,为TNF超家族的成员,且TRAIL与死亡受体结合可激活细胞凋亡途径(包括杀死易感细胞)。
其他自主研发的产品
处于临床前研究的药物包括:
•HLX09,拟开发作为治疗实体瘤的CTLA-4抑制剂。
•HLX23,拟开发作为治疗实体瘤的分化簇73(“CD73”)抑制剂。
•HLX24,拟开发作为治疗实体瘤的分化簇47(“CD47”)抑制剂。
•HLX26,拟开发作为治疗实体瘤的LAG3抑制剂。
•HLX59,拟开发作为治疗实体瘤的分化簇27(“CD27”)抑制剂。
•HLX51,拟开发作为治疗实体瘤的0X40抑制剂。
•HLX52,拟开发作为治疗实体瘤的TIM-3抑制剂。
•HLX53,拟开发作为治疗实体瘤的TIGIT抑制剂。
•HLX58,拟开发作为治疗实体瘤的Claudin18.2抑制剂。
