罗氏与合作伙伴新基(Celgene)开展的靶向抗癌药Gazyva(obinutuzumab,阿托珠单抗)联合Revlimid(lenalidomide,来那度胺)治疗复发性或难治性滤泡性B细胞淋巴瘤的Ib期临床研究GALEN(NCT01582776)的数据已于近日发表于国际医学期刊《BLOOD》。
该研究是一项开放标签、3+3设计研究,入组了19例既往已接受罗氏美罗华(Rituxan)治疗的复发性或难治性滤泡性淋巴瘤(FL)成人患者(平均年龄61.5岁)。研究中,患者接受口服来那度胺治疗,同时接受静脉输注Gazyva。具体用药时间表为:在第1周期的第1-21天和第2周期的第2-22天分别口服10mg(n=7)、15mg(n=3)、20mg(n=6)、25mg(n=3)来那度胺,患者同时在第1周期的第8、15、22天和第2-6周期的第1天接受1000mg Gazyva静脉输注治疗,28天为1个周期。
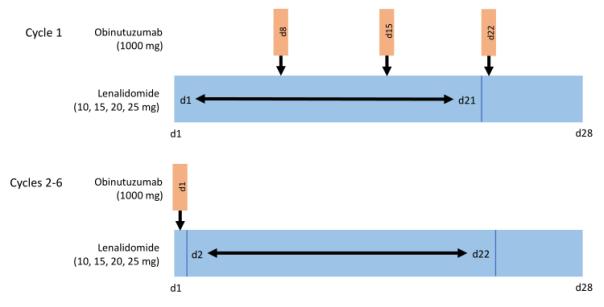
研究人员基于第1周期的剂量限制毒性以3+3设计方式开展剂量递增,以确定来那度胺的最大耐受剂量。主要终点是确定用于II期研究的来那度胺与美罗华固定剂量组合中的来那度胺剂量,次要终点包括安全性、耐受性和初步的抗肿瘤活性。
最终分析的中位随访时间为38.1个月(95%CI:35-41.6)。数据显示,经过6个周期治疗后,12例患者实现患者,缓解率为63.2%(95%CI:38.4-83.7)。其中8例为完全缓解,3例为未确定的完全缓解,1例为部分缓解。在治疗第3年时,疾病无进展生存率为52.1%(95%CI:28.0-71.6),总生存率为73.3%(95%CI:47.2-87.9)。

安全性方面,所有患者均经历了至少一个不良事件。不良反应164例,最常见的为便秘(52.6%)、中性粒细胞减少(47.4%)和虚弱(36.8%)。大多数事件为1级或2级(n=139)。3级或4级不良反应中,64.3%为中性粒细胞减少,但无发热性中性粒细胞减少病例。2例患者中发生了4种剂量限制性毒性,但研究人员认为这些与治疗无关,并且没有达到最大耐受剂量。13例(7.9%)不良事件仅与Gazyva有关,54例(32.9%)仅与来那度胺有关,32例(19.5%)与联合用药有关。
该研究结果显示,口服来那度胺联合Gazyva治疗复发性或难治性滤泡性B细胞淋巴瘤具有可接受的耐受性和安全性,同时表现出显著的疗效。根据研究结果,研究人员确定,推荐20mg来那度胺+1000mg Gazyva固定剂量组合用于II期临床研究。
研究人员表示,先前的研究显示来那度胺在体内可引起自然杀伤细胞的激活,这进一步提高了随后的Gazyva输注疗法的疗效。在GALEN研究中,有40%的患者对美罗华治疗无效,20%的患者对最后一次治疗无效。该研究结果表明,将来那度胺与Gazyva联合用药可能比来那度胺与美罗华联合用药更有效。
Revlimid是一种免疫调节剂,其活性药物成分为来那度胺,是沙利度胺的新一代衍生物,无致畸毒性,药效比沙利度胺强100倍,具有免疫调节、抗血管生成和抗肿瘤特性。Gazyva是首个糖基化的II型抗CD20单克隆抗体,靶向B细胞表面的CD20分子,能够直接诱导B细胞死亡。该药可增强抗体依赖性细胞毒性作用(ADCC)及直接的细胞死亡诱导作用。
滤泡性淋巴瘤(FL)是一种最常见类型的惰性(生长缓慢)非霍奇金淋巴瘤(NHL),约占所有NHL病例的五分之一。其被认为是不治之症,大多数患者会经历反复复发,而且病情每复发一次,就变得更加难以治疗,因此该领域存在着远未满足的巨大医疗需求。
目前在临床上,美罗华是用于初治滤泡性淋巴瘤的标准护理药物。今年7月,罗氏与新基宣布,来那度胺+美罗华组合方案(R2)治疗晚期复发性/难治性性淋巴瘤(滤泡性淋巴瘤和边缘区淋巴瘤)的III期临床研究AUGMENT达到了主要终点。根据该研究数据,双方已计划在2019年上半年提交监管申请。如果获批,这款R2方案将为惰性淋巴瘤患者群体带来一种新的、无化疗的治疗方案。(详见:Revlimid治疗惰性淋巴瘤III期临床成功)(新浪医药编译/newborn)
文章参考来源:Lenalidomide plus obinutuzumab demonstrates antitumor activity in relapsed follicular B-cell lymphoma
