近日,顶尖学术期刊《科学》推出了“变革生物学的技术”特刊,为我们详细介绍了数种目前正在给生物学领域带来革新的重磅技术。在今天的这篇文章里,药明康德微信团队为各位读者朋友们整理了其中关于CRISPR/Cas的内容,一道展望它能如何指引基因工程的未来。
CRISPR-Cas基因编辑系统的多样性、模块性和高效性正在掀起一场生物技术革命。RNA指导的Cas酶已经被用来作为在培养细胞,动物和植物中操纵基因组的工具。它不但加快了基础研究的步伐,而且让临床和农业突破成为可能。日前,CRISPR-Cas基因编辑系统的鼻祖之一,加州大学伯克利分校的Jennifer A. Dounda博士和她课题组的Gavin J. Knott博士在《科学》杂志上撰文,对这一技术的优势、进化趋势和应用进行了盘点。
从微生物的免疫系统到可编程的基因组编辑工具
CRISPR-Cas系统是微生物体内的一种RNA指导的适应性免疫系统。它利用RNA来引导核酸酶与特定核酸序列相结合并且将它们切断。当病毒入侵细菌时,细菌能够捕捉到外来遗传物质的片段并且将它们整合到自身基因组中的CRISPR序列中。CRISPR序列转录生成的CRISPR RNA(crRNA)能够与Cas核酸酶相结合,通过与靶点核酸序列进行碱基配对为Cas核酸酶提供结合特异性。Cas核酸酶和crRNA结合之后,能够在细菌体内起到监控病毒入侵的作用,当与crRNA匹配的遗传片段再度出现时,Cas核酸酶能够切断这些遗传片段,从而提供免疫保护作用。
CRISPR-Cas适应性免疫系统(图片来源:《科学》)
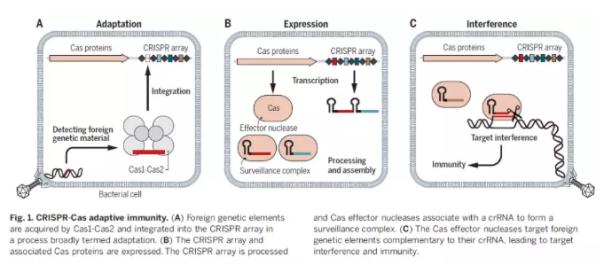
在众多天然CRISPR-Cas系统中,2类(class 2)系统只需要一个RNA指导的Cas核酸酶就能够完成对靶点的切割。其中Cas9核酸酶成为了第一个被用于基因组编辑的Cas效应子。Cas9有诸多特点让它能够进行准确而有效的编辑。Cas9通过特异性识别crRNA和它与反式激活crRNA(tracrRNA)之间的相互作用保证Cas9只和对应的指导RNA相结合。而crRNA和tracrRNA可以被融合成一个指导RNA(sgRNA)。最后,Cas9需要与特定PAM序列旁边的DNA片段相结合才能触发Cas9的双链DNA切割功能。世界各地的科学家们选择Cas9作为基因编辑工具的原因正是因为这种核酸酶的可控性和通过修改sgRNA靶点就能改变Cas9切割位点的便捷性。
虽然Cas9仍然是最常用的Cas效应子,但是科学家们已经将Cas效应子的范围扩展到其它类型的Cas蛋白中去。CRISPR-Cas12a能够靶向DNA序列,而CRISPR-Cas13a能够靶向RNA。这些由RNA指导的核酸酶系统的可编程(programmability)特点是CRISPR-Cas系统能够在精准基因组编辑以外获得广泛应用的关键。
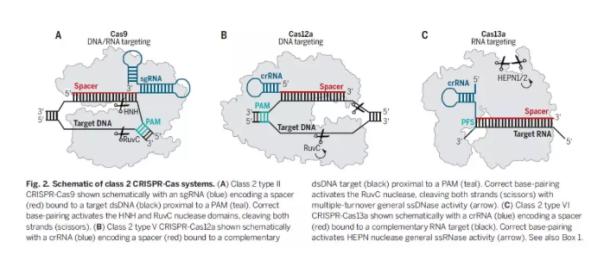
2类CRISPR-Cas系统(图片来源:《科学》)
Cas媒介的基因组编辑的应用
虽然Cas的应用范围已经得到扩展,但是精准基因组编辑仍然是CRISPR革命的前沿。Cas9和Cas12a能够在特定位点触发双链DNA断裂,在细胞通过非同源末端连接(NHEJ)或同源定向修复(HDR)对双链DNA断裂进行修复后基因组编辑就会发生。
作为精准基因组编辑工具,Cas9和Cas12a能够在多种细胞种类和生物中起作用。它们可以用于全基因组筛选来研究基础生物功能,或者发现和验证复杂遗传病的潜在药物靶点。在临床试验中,Cas核酸酶可以治疗由已知遗传因素导致的疾病,例如在杜氏肌营养不良症(DMD)中,使用基因编辑可以修正基因突变或者诱发转录过程跳过有缺陷的外显子。Cas9可以用于让导致肌萎缩侧索硬化症(ALS)和亨廷顿病(Huntington’s disease, HD)等神经疾病的致病基因失活。除了对体细胞进行基因编辑,这一系统还有在人类胚胎中修正基因突变的潜力,从而在人类生殖细胞中产生可遗传的变化。
然而,值得注意的是精准编辑仍然是一个挑战,因为NHEJ导致的修复结果可能与期待的HDR导致的修复结果竞争。另一种策略是将Cas效应子与碱基编辑器(base editor)融合在一起。这可以限制不想要的编辑并且消除修复模板的需求。与切割DNA然后进行修复不同,切口酶Cas9(nCas9)媒介的碱基编辑将单碱基编辑器携带到指定靶点,并且在促进碱基变换的同时不产生双链DNA切割。如今Cas9媒介的单碱基编辑器让研究人员能够在特定基因组位点生成任意一种碱基变换结果。展望未来,下一代的Cas媒介的基因组编辑器很可能包括碱基编辑器,它们的碱基编辑活性可能通过构象变化,与Cas9媒介的靶点DNA结合偶联在一起。

CRISPR-Cas系统的各种应用(图片来源:《科学》)
使用dCas9调控转录过程
Cas9是一个模块式的平台,它的DNA结合能力和核酸酶活性分属不同的模块。通过在Cas9核酸酶蛋白域引入突变,可以生成催化活性缺失的Cas9(dCas9)。它可以成为募集蛋白的骨架,在干扰特定位点转录过程时不会对DNA产生永久的影响。使用dCas9为功能性基因筛检带来革命性的变化,因为它让在多种细胞中进行迅速,特异性,高通量的基因敲低成为可能。这些研究进展凸显出在操作基因组的同时不引入永久性DNA损伤的实用性。例如,将dCas9与TET1(一种去甲基化酶)融合,可以在脆性X综合征(fragile X syndrome)神经元和小鼠模型中靶向失调的FMR1位点,并且逆转表型。
使用靶向RNA的Cas在转录后进行基因工程
与产生永久基因变化相对,Cas效应子可以通过靶向RNA对转录组进行暂时干扰。利用呈现PAM序列的寡核苷酸,Cas9系统可以被改造成可编程的RNA编辑工具(RCas9)。RCas9可以用于消除致病RNA,修复mRNA剪接错误,或者降低三核苷酸重复序列表达的蛋白水平。目前获得的成功表明,Cas9可能在转录后基因工程领域大有作为,例如与单碱基RNA调控子融合来实现对特定RNA位点的调控。
Cas13是靶向RNA领域最新涌现的多功能工具。Cas13a系统是一个RNA指导的核糖核酸酶(RNase),它可以在哺乳动物和植物体内用于有特异性地敲低RNA。与Cas13a功能和进化相似的Cas13b具备可编程的RNase活性,它已经被用于在哺乳动物细胞中实现RNA干扰和RNA编辑。Cas9和Cas13靶向RNA的系统除了支持基础研究以外,在临床上可以达到和反义寡核苷酸疗法相似的临床应用,在不产生永久性遗传变化的情况下,治疗急性非孟德尔疾病(acute Mendelian patholgies)。
可编程核酸成像
对于特定基因组位点,mRNAs,和非编码RNAs来说,在细胞中的特定时空分布对它们的功能至关重要。将dCas9与荧光报告基因融合在一起,研究人员已经能够对基因组中的重复位点在活细胞中进行成像。然而,限制dCas9在基因组特定位点分布研究中应用的原因是,对于非重复序列,这一手段的信噪比较低。克服信噪比不足的一个方法是在sgRNA上附加多个MS2序列,这些MS2序列能够与MS2序列结合蛋白相结合,而将MS2序列结合蛋白与荧光蛋白融合在一起,则能够有效地增强信号强度。使用靶向RNA的RCas9让研究人员能够在活细胞中追踪RNA,从而让追踪携带重复扩增序列的RNA成为可能,这具有重要临床意义。
核酸检测和诊断
在Cas13a和Cas12a中RNA指导的核酸酶活性促进了创新核酸检测工具的研发。对于Cas13和Cas12a来说,靶点核酸通过与指导RNA的碱基配对,会激活普通的核酸酶活性。利用这种可控的核酸酶活性,Cas13被用于从大量RNA中检测特定RNA序列的存在。基于这一研究开发出的SHERLOCK技术平台,能够同时检测出登革热和寨卡病毒的单链RNA的存在。
Cas12a有着与Cas13相似的靶向单链DNA的可控核酸酶活性。利用这种活性,DETECTR系统是一个基于CRISPR的DNA检测和诊断技术平台。与等温预扩增相结合,DETECTR系统能够迅速准确地检测出人乳头瘤病毒(HPV)的临床相关类型。
CRISPR-Cas系统的特异性和运输
与小分子药物或抗体疗法的脱靶效应相比,Cas核酸酶的脱靶效应尤其危险,因为它会造成基因组的永久性改变。因此,改进Cas的特异性和靶向运送尤为关键。研究人员已经在改进Cas酶和sgRNA设计上取得了长足进步,大幅度提高了核酸酶的特异性。而且,预测靶向结果的工具和对基因表达的时空调控为降低脱靶效应提供了全面的应对策略。
优化运送Cas系统的载体仍然是一个重大挑战,特别是在人体可以对sgRNA和Cas产生免疫反应的情况下。在实验室中,研究人员可以使用电穿孔、转染、直接注射等方法将编码Cas系统的DNA、mRNA、或RNA蛋白复合体导入细胞中。但是,其中很多种方法在临床条件下并不适用。而且,将个体较大的Cas核酸酶与指导RNA结合形成的复合体装进病毒载体仍然是个挑战。解决这个问题的一个策略是利用个体较小的Cas同系物,或者对系统进行最小化,以便将它们装进病毒载体。另外一种方法是使用纳米材料完成对特定细胞种类的定向运输。最近的研究表明,直接注射携带Cas9-sgRNA的纳米颗粒在小鼠模型中能够纠正DMD突变,导致临床症状得到缓解。未来基于CRISPR疗法的成功,很大程度上依赖于运送Cas系统载体方面的进一步研发。
结语和未来
CRISPR-Cas技术提供了一种修改、调控和观察基因组的便捷、而且具备很强适应性的工具。这让它可以在广大领域中得到生物研究和生物技术方面的应用。CRISPR-Cas工具极大地加快了科学研究的脚步,而基于Cas的生物技术的研发同样进步迅速。多项基于Cas9的临床试验正在或即将进行。这些临床试验的结果将指引未来体细胞基因编辑在体外和患者中的应用。CRISPR-Cas9在农业方面的应用已经产生了可以进入市场的产品。CRISPR-Cas工具箱日渐扩展的应用确立了这一系统在基因组编辑,甚至是基因工程领域的前沿位置。
参考资料:
[1] Knott and Doudna. (2018). CRISPR-Cas guides the future of genetic engineering. Science, https://doi.org/10.1126/science.aat5011
