2010年,在国际药品采购机构UNITAID的支持下,药品专利池(MedicinesPatent Pool, MPP)在日内瓦成立。MPP通过与原研药企就药品专利的自愿许可进行谈判,原研药企将其药品专利放入专利池中,仿制药企向MPP申请获得专利池中的专利实施许可,生产并向中低收入国家供应仿制药。
MPP的建立有其时代背景。2002年WTO通过的《TRIPS协议与公共健康多哈宣言》重申了发展中国家运用TRIPS灵活性获得可负担药品解决本国公共健康问题的权利。此后,包括泰国、马来西亚、巴西、南非等国政府都相继针对受到专利保护的昂贵原研药实施强制许可生产或进口仿制药以应对因艾滋病等传染性疾病带来的公共健康问题。在强制许可“浪潮”下,一方面不少跨国制药公司感到失措,需要一种机制来平衡或扭转专利药频频被政府宣告实施强制许可的局面,另一方面,各国药品专利强制许可的决策过程充满政治博弈,结果充满了不确定性。
MPP以创新的方式在原研药企追求投资回报的商业诉求(甚至垄断利益)与政府保障公民生命权和健康权的职责之间寻求平衡,一定程度上缓解了此起彼伏的药品专利强制许可带来的紧张。MPP理念形成之初便得到了倡导药品可及性的国际组织、政府、公民社会组织、学者和社会活动家等各界的认同和支持。原无国界医生“病者有其药”项目法律与政策部主任、荷兰律师胡艾伦女士(Ellen FM ‘t Hoen)担任MPP首任执行董事。
MPP的许可模式
MPP的建立之初是为了推动和促进高价抗艾滋病新药在发展中国家的可及性。MPP本身并不生产和销售仿制药。它与专利权人谈判获得专利实施许可,再通过意向表达流程(Expression of Interest, EOI)邀请仿制药企申请专利池中的实施许可。如药企有意愿申请MPP许可,可以在线填写EOI,提供有关生产能力、质量有保障药品的生产记录,研发能力以及监管合规等方面的具体信息,MPP通过EOI中的信息筛选合格的仿制药企授权实施许可,获得许可的仿制药企向许可协议约定的中低收入国家生产和销售仿制药。
MPP鼓励仿制药竞争,价格大幅下降,让更多人可以获得治疗。MPP的许可协议通常会约定是否支付许可使用费以及费率。从现实角度而言,由于不少中低收入的发展中国家政府和患者支付能力有限,加之市场规模小,对不少欧美原研药企并没有太大吸引力。MPP的许可机制一方面可以让部分中低收入国家的患者获得廉价新药,另一方面也让原研药企不必费力地为新药开拓这些不赚大钱的市场,却还能获得许可使用费,或免费许可但赢得良好的社会声誉,这是一个双赢的局面。
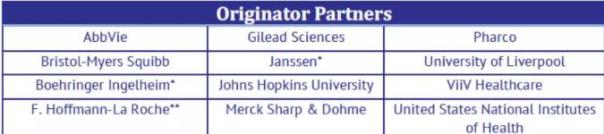
目前,MPP已与多家跨国制药公司和研发机构达成许可协议。下表为目前与MPP合作的制药公司和研发机构名单。
MPP许可的特点
自愿许可在专利实施中比较常见,MPP由于其公共健康导向的商业模式而具有普通自愿许可所不常见的特点:[1]
广泛的地理范围。现有的MPP许可覆盖共达131个国家,涵盖世界银行标准下所有低收入国家和50%-80%的中等收入国家。在这些国家有多达90%的艾滋病患者和65%的丙肝患者。并且,如果MPP中抗艾滋病药儿科药许可全部得以实施的话,将惠及全球99%的艾滋病儿童患者。
药品质量有保障。专利权人通常要求MPP将其专利分许可(sub-license)给有能力通过WHO预认证或者ICH认定的“严格监管部门”(如FDA、EMA)标准的仿制药生产企业。
鼓励仿制药竞争。所有MPP许可都不是独家的排他许可,有意向并符合条件的仿制药厂都可以申请MPP许可。
专利信息的披露。将某个药品的专利实施许可授权给MPP的专利权人需披露该药品的专利信息。在原研药企与MPP签订的许可协议中通常都列明了该药品在各国的专利信息。
放弃数据独占权。专利权人将药品专利许可授权MPP需承诺放弃其享有数据独占权。不仅如此,仿制药企在MPP许可下生产的药品在协议约定的国家上市销售时,通常也需放弃其在这些国家可享有的独占权。
与TRIPS灵活性相容。MPP的所有协议条款都与TRIPS协议灵活性兼容,MPP的许可并不禁止仿制药企在协议约定的地理范围外生产销售药品,只要不侵犯其专利。[2] MPP的许可也不禁止仿制药企对原研药企所拥有的药品专利提出挑战或对专利申请提出反对,甚至不禁止任何国家政府对专利池中的药品专利宣告实施强制许可。
透明度。所有MPP许可信息均对外公开,MPP的所有许可协议均在其网站可查。
除以上外,MPP也在一定程度上鼓励创新,这一点比较突出地表现在儿科剂型和固定剂量组合制剂(FDC)的开发上。MPP会通过仿制药企在EOI中提交的信息考虑申请人对生产药品所需剂型的准备程度,包括FDC和儿科剂型,因为MPP许可允许仿制药企开发FDC和儿科剂型。[3]这一点对于艾滋病治疗极为重要,有效的鸡尾酒治疗方案通常都需要3-4种药物的固定剂量组合。而很多情况下,组合制剂中仅一个单药的某个专利就足以阻止仿制药企开发FDC。
和很多技术转让相似,MPP许可协议通常包含了技术转让条款,专利权人将许可实施的专利技术相关的技术知识(know-how)也转让给仿制药企,技术知识的内容包括但不限于临床数据。
MPP的成就
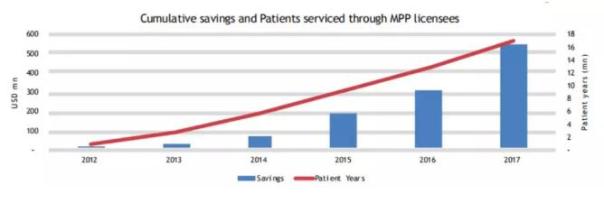
MPP建立至今已有八年,对推动和促进中低收入国家和患者获得可负担的救命药作出了很大的贡献。MPP最初仅为推动抗艾滋病新药的可及性,但近几年由于全球抗结核病的严峻形势以及很多国家都面临丙肝新药价格过高无力负担的挑战,MPP将药品种类扩展至治疗结核病和丙肝的新药。至今,MPP与9个专利权人(原研药企或研发机构)签署许可协议,获得13个艾滋病新药、两个丙肝的直接作用抗病毒新药、一个结核病治疗方案以及一个治疗艾滋病技术平台的专利实施许可。根据KPMG的统计,截至2017年12月,就抗艾滋病药和丙肝药而言,获得MPP许可而生产的仿制药销售覆盖了128个国家,2012年至2017年累计节省5亿5300万美元,累计1700万患者获得这些药品。预计到2028年,通过MPP直接节省的药品费用将达23亿美元。[4]八国集团和联合国艾滋病高级别会议将MPP评价为“一种促进药品可及性的有前途的创新方法”。[5]
从公开的信息看,中国有四家药企获得MPP许可,主要是生产和销售抗艾滋病药。相比而言,印度药企在这方面表现得更为积极,包括Cipla、Mylan、Aurobindo等多家印度知名仿制药企都获得了MPP许可。
MPP面临的争议
尽管取得了以上成就,MPP是解决药品可及性的完美模式吗?并不是,MPP也招来不少批评。
第一,MPP许可的本质依然还是原研药企与仿制药企之间的自愿许可,MPP以促进公共健康为导向起着中间作用,一定程度上实现了仅凭单个或少数仿制药企势单力薄与原研药企谈判所不能实现的效果。虽然MPP尽最大努力与专利权人谈判获得许可,并使许可尽可能覆盖更多受益的国家和患者,但是否给予许可、许可的范围以及其他附加条件等最终还是由作为专利权人的原研药企决定。
原研药企对MPP许可下生产的仿制药可以销售的地理范围会作出严格的限制,像巴西和中国这样的大市场通常不被列入许可销售的地理范围内。比如,从MPP网站公开的信息显示,有三家中国药企获得了关于富马酸替诺福韦二吡呋酯(TDF)的MPP许可,根据许可协议,中国药企生产的TDF仿制药(包括含有TDF组合制剂)可以销往112个国家,但中国不在其列。2017年9月,吉利德与MPP修改了关于替诺福韦艾拉酚胺(TAF)的许可协议,Cipla、Natco、Aurobindo等知名印度仿制药厂均获得TAF的MPP许可。与原来的协议相比,许可销售国家范围扩大至116个国家,增加了白俄罗斯、马来西亚、菲律宾和乌克兰四国。但有36个中等收入国家被排除在许可协议的地理范围外,意味着这36个中等收入国家约370万艾滋病患者很难获得价格可负担的TAF仿制药。中国有三家药企获得TAF的许可,但同样无法在中国市场销售。[6]
第二,MPP机制整体上削弱了很多发展中国家运用专利挑战、平行进口、强制许可等TRIPS灵活性解决本国公共健康问题的积极性和正当性。比如,受益国无需诉诸强制许可便能采购廉价仿制药,获得MPP许可的仿制药企可能也不会再积极地挑战专利。但是,如前所述,现在仍有一些国家及相当数量的患者被排除在MPP许可的受益范围外。而且,目前列入MPP的药物种类和适应症有限,当前主要受益的还是艾滋病患者,而TRIPS灵活性的运用对于诸如抗癌新药以及其他非传染性疾病新药的可及性依然具有非常重要的意义。[7]
而且,原研药企也在策略性地利用MPP机制。2015年初,默沙东与MPP达成协议,将其抗艾滋病新药雷特格韦(Raltegravir)儿科药的专利授权给MPP,许可协议约定的国家范围可以覆盖98%的儿童患者,这是至今默沙东授权给MPP的唯一一个产品。但有观察人士一针见血地指出,这是“对一个现实问题的错误解决方案”,认为这个许可协议看上去更像一场公关,因为它并没有使最需要这些药品的患者获得药品,中国又被排除在协议之外。“如果发展中国家运用TRIPS协议灵活性的权利能得到尊重,并没有必要从MPP获得许可...…通过诸如MPP这样的机制获得自愿许可事实上大大削弱了这些国家的谈判力量以及运用TRIPS灵活性的能力。”[8]某些原研药企利用MPP也是为了疏解其专利垄断而引发的来自社会各界的批评。
第三,MPP的运作也从一个侧面暴露了药品可及性的某些问题,MPP自身或许无法解决。比如,儿科药的可及性问题。MPP目前有三款抗艾滋病儿科药获得原研药企的许可授权,分别是ViiV Healthcare的阿巴卡韦,艾伯维的洛匹那韦/利托那韦和前述默沙东的雷特格韦,尽管这些儿科药的许可条件比较宽松,如原研药企不要求许可使用费,并且地理范围较大,甚至可以惠益全球99%的儿童患者,[9]但从下表所列出的仿制药企申请成人用药和儿科药的对比可以看出,仿制药企对于开发儿科药的积极性远远不如成人用药。有业内人士指出,诸如抗艾滋病儿科药可及性面临的真正问题并不是专利,而是缺乏投资回报,以至于就算没有专利障碍,仿制药企也太不愿意生产。
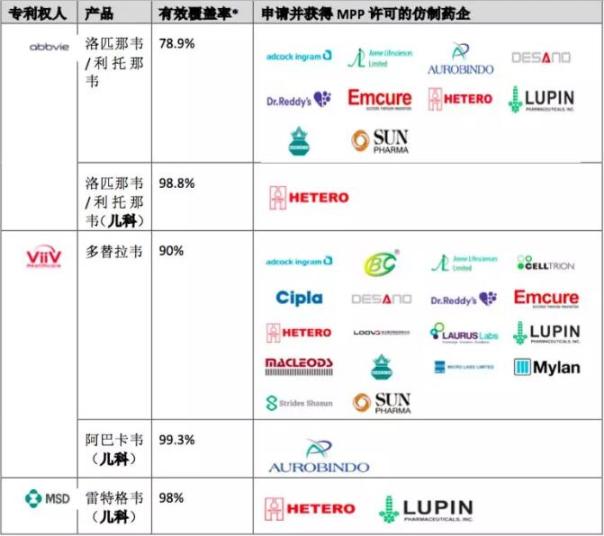
*有效覆盖率是指可从许可获益的所有发展中国家的患者比例。
MPP的未来展望
MPP创造性地运用了自愿许可和专利池的机制,推动和促进救命药的可及性,恵益于支付能力有限的中低收入国家和患者。2016年,WHO和《柳叶刀》基本药物政策委员会建议,所有受专利保护的基本药物都应当列入MPP的工作范围。[10]提出这项建议也是因为很多中低收入国家面临着抗癌新药以及其他新药的可及性问题。与此同时,抗生素耐药问题逐渐受到关注,一些研究报告也提议MPP可以在这方面发挥重要作用。今年5月,在第71届世界卫生大会上,MPP公布了未来五年的战略规划,除了在治疗艾滋病、丙肝和结核病领域继续推动现有药物和新药在中低收入国家的可及性之外,还将把WHO基本药物示范目录中的专利药作为未来的工作方向,以支持其他疾病的患者对基本治疗的需求。[11]为此,针对给众多中低收入国家造成负担的疾病及相应的治疗药物,MPP做了可行性研究(见下表)。[12]
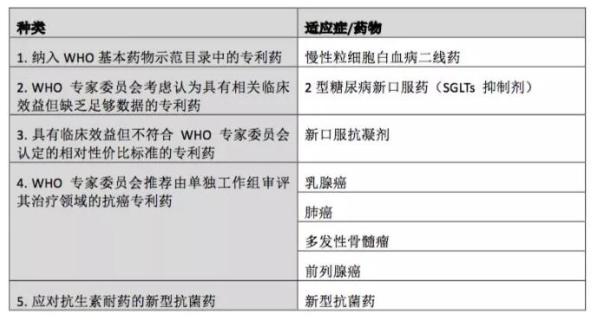
比如,WHO基本药物示范目录委员会推荐达沙替尼和尼洛替尼作为费城染色体阳性慢性髓性白血病的二线治疗药物。这一疾病的一线药物主要是伊马替尼,在大多数国家专利已到期。不过会有相当数量的患者会对伊马替尼产生耐药,对于这些患者,达沙替尼和尼洛替尼是比较好的二线治疗方案。除此以外,达沙替尼也可作为治疗急性淋巴细胞白血病的一线药物。达沙替尼和尼洛替尼在中低收入国家的可及性程度各异,这两个药大概在2020至2030年期间专利到期,目前还没有仿制药,有一些国家通过原研药企的赠药计划或折扣价格才获得这两种新药。MPP分析认为,虽然对于达沙替尼和尼洛替尼而言,中低收入国家的市场相对比较小,对仿制药企缺乏吸引力,但是,参照伊马替尼的例子,一些仿制药企在进入高收入国家市场之前是先在中低收入国家的小规模市场中开发和销售的,MPP的许可模式有助于推动仿制药的竞争并可持续地扩大这些药品的可及性。
再以2型糖尿病为例。2型糖尿病影响着中低收入国家大约3亿患者,由此带来的经济影响相当深远,2030年预计将会给中低收入国家造成约110亿美元的经济损失。一线治疗方案二甲双胍费用较低,在中低收入国家可及性尚可,但是大多数2型糖尿病患者若干年后都需要二线药物。2017年,WHO专家委员会审议了六种二线治疗方案,其中SGLT-2抑制剂作为心血管疾病风险高的患者的二线治疗显示了相关临床效益,总死亡率降低,但委员会认为还需要其他试验加以确认。MPP研究认为,如果将MPP许可模式适用于SFLT-2抑制剂,110万至330万糖尿病患者可能获得治疗,依据现有对心血管疾病风险高的患者的相关临床效益数据,可能可以避免3.1万至12.6万例重大心血管不良事件发生。
对于比较热门的抗癌药,WHO成立专门的工作组来全面评估一系列抗癌新药以决定是否纳入基药示范目录。相应的,MPP在可行性报告中分析了厄洛替尼、吉非替尼、阿法替尼和氯唑替尼四个肺癌新药,阿比特龙和安扎鲁胺两个前列腺癌新药,培妥珠单抗、阿托曲妥珠单抗和拉帕替尼三个乳腺癌新药,以及治疗多发性骨髓瘤的来那度胺。这些药物在中低收入国家的可及性都比较有限,MPP许可机制可以发挥一定的作用。
另外,中低收入国家对于生物药也有很大需求,但新药少且昂贵。不少人认为或许MPP可以通过其许可模式探索如何推动这些国家获得生物类似药(SBP)。但是,SBP的开发和生产与小分子仿制药有很大差别,最大的挑战是类似药生产者需要开展更广泛的研究来证明类似药与参比制剂相比具有相当的有效性和安全性;再加上各国对SBP的上市监管要求各异,生物类似药的开发又需要大量的资金投入,这些确实大大削弱了MPP在生物类似药可及性中可以发挥的作用。不过,MPP许可中的技术转让环节或许对克服生物类似药研发和生产中的某些困难会有所助益。
MPP对中国制药企业的意义
在现阶段,与印度药企相比,中国药企申请MPP许可并不积极,主要原因可能是中国本土市场被排除在外,而许可销售的其他国家均市场规模小,而开拓成本较高。但是,MPP作为一种国际机制,对于中国制药企业的未来发展有着重要意义。
就近而言,MPP对提出申请的仿制药企的筛选标准、对药品质量的要求等为中国制药企业提高研发生产能力试水国际市场搭建了良好的平台,也提供了与优秀跨国制药企业开展技术合作的契机。不远的将来,更多创新药可能会纳入MPP许可范围,生物药可能会借鉴MPP许可模式满足中低收入国家对生物类似药的需求,MPP可以成为更多中国制药企业进入国际市场的渠道之一,积极参与国际竞争。更长远地看,随着中国企业技术创新能力的不断提高,将会出现越来越多由中国药企自主研发的全球新药,作为专利权人,中国药企也完全可以利用MPP这个成熟的平台寻求海外合作,开拓国际市场。
[1] Key features of MPP licenses: https://medicinespatentpool.org/what-we-do/global-licence-overview/licensing-terms/
[[2] MPP FAQ.
[3] MPP EOI, https://medicinespatentpool.org/what-we-do/expression-of-interest/
[4] MPP: Update on Progress of MPP Sub-licensees, July 2018.
[5] MPP: Five years of patent pooling for public health-Annual Report2015.
[6] I-MAK: The Roadmap-Special Edition Report-Tenofovir AlafenamideFumarate, April 2018.
[7] Ellen FM ‘t Hoen, et al., Medicine procurement and the use offlexibilities in the Agreement on Trade-Related Aspects of IntellectualProperty Rights, 2001-2016.
[8] Merck’s HIV patent agreement ignites criticism, https://www.scidev.net/global/hiv-aids/news/merck-hiv-patent-agreement-monopoly-criticism.html
[9] Medicines Patent Pool at 5 Years: Promises Kept, Changes Ahead-AnInterview with Greg Perry, http://www.ip-watch.org/2015/07/30/medicines-patent-pool-5-years-along-promises-kept-looking-ahead/
[10] WHO: WHO Submission to the UN SG High Level Panel on Access to Medicines, 7 March 2016. https://static1.squarespace.com/static/562094dee4b0d00c1a3ef761/t/56e746279f7266a586c2b893/1457997352
[11] The Medicines Patent Pool 2018-2022 Strategy: https://medicinespatentpool.org/who-we-are/strategy/
[12] MPP: Exploring the Expansion of the Medicines Patent Pool’s Mandateto Patented Essential Medicines, 24 May 2018.
