作者:强森
药品撤市,理由很多,大致分3种情况:安全性问题、同类产品市场竞争、监管部门政策变化。安全性,作为药品三大属性中的重中之重,如果存在问题,或爆发大面积药害事件,那撤市则是必然之举。药品因安全性问题而被要求撤市,主要涉及心血管毒性、肝毒性、肾毒性、神经毒等。其中,心血管毒性发生比例相对较多,日益得到药审部门的重视,值得药物研发人员的关注与深挖。
近年来,因心血管毒性而撤市的18个药物
通过查询数据库、国内外相关专业网站、文献,因心血管毒性而被药审部门要求撤市的药物,查到18个(详情见表1);主要存在的心血管不良反应事件包括:心梗、心脏猝死、QT间期延长、心律失常等;典型代表药物,主要有用于白血病治疗的普纳替尼、用于类风湿关节炎治疗的罗非昔布、以及用于减肥的西布曲明等。
表1:近年,因心血管毒性而撤市的18个药物


三大经典药物撤市案例
经典案例1:罗非昔布~非甾抗炎
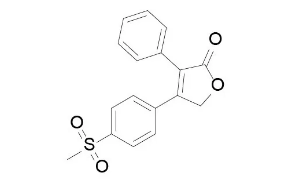
又叫罗非考昔,COX-2抑制剂,由默沙东(MSD)开发研制,该药适用于骨关节炎止痛,成人类风湿性关节炎、原发性痛经、成人急性疼痛、和有或无先兆性偏头痛,2岁及以上儿童(体重10公斤或以上)少关节或多关节型幼年类风湿性关节炎的相关症状;1999年获美国FDA批准上市,商品名为Vioxx®;因为长期大剂量服用将引起心肌梗塞和心脏猝死风险增加,Rofecoxib于2004年被默沙东撤市。
罗非考昔曾被誉为“超级阿司匹林”,在全球82个国家获准,在召回前为默克公司带来一年25亿美元的销售收入,位于美国畅销药第20位,全球已有8400万人服用过本品。之所以被召回,是源于默克公司自愿进行的一项APPROVe研究,而该项研究本意并非为评估本品的心血管疾病风险而进行的,恰恰相反,默克公司是为了进一步扩大本品适应证,试图用于癌症患者而设计了APPROVe。但事与愿违,默克公司也因此而失去了公司的拳头产品,且由于召回,默克公司的新产品口服COX-2抑制剂etoricoxib (Arcoxia)的上市也蒙上了一层阴影(至今未或FDA批准,但我国已批准销售,且有企业在近3年中开始对该品种进行申报)。应对不利情形,默克公司原本可以采取修改说明书的方式继续销售。但“考虑到可以采用替代治疗,以及数据所揭示的问题,公司决定,主动召回是负责任的做法”,默克公司的这一行动也得到了FDA的肯定。
罗非昔布的失败,成就了辉瑞公司的塞来昔布。在当时,辉瑞公司本打算靠自己的第二代COX-2抑制剂伐地考昔来抗衡默克的罗非昔布,而出现该事件后,辉瑞公司改变策略,强调一个药物的安全性远比疗效来得重要,因此,经过长期临床实践的塞来昔布更可能赢得患者信赖。因此,西乐葆2005年销售预期从24.72亿美元调高到36.77亿美元。
那么,罗非昔布到底是什么原因而导致该灭顶之灾呢?有学者分析:由于昔布类药物选择性抑制了前列腺素的合成,却没有抑制血小板,因此使血栓性事件的危险性升高;但也有学者认为恰恰相反,选择性抑制动脉粥样硬化斑块内的COX-2,可以降低血管感染、减慢血管性疾病的发展,甚至可以起到保护作用;还有学者认为可能与罗非昔布的代谢物的毒性有关,但目前尚缺乏关于罗非昔布代谢物的研究报道。更多的学者还是认为,塞来昔布和罗非昔布两种药物化学结构和代谢方式的不同可能是其心血管安全性差异的原因所在,从化学结构的整体来看,塞来昔布含有磺酰胺的基本结构,而罗非昔布是呋喃酮类药物。它们具有共同的COX-2抑制作用,但在其他方面的作用和在体内的代谢却可能有所不同....
经典案例2:西布曲明~减肥药
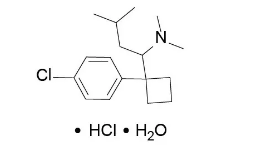
由雅培开发,属5-羟色胺-去甲肾上腺素-多巴胺再摄取抑制剂;该药与降低了卡路里的饮食结合,用于肥胖的控制,包括体重的降低和维持;1997年11月获得美国食品药品管理局(FDA)批准;由雅培上市销售,商品名为Meridia®。自2010年以来,因招致心血管事件的增加和导致中风等相关的副作用,已逐步撤市。
自西布曲明上市,其安全性问题就受到关注。从欧洲EMA网站公布信息可知,1999 年10 月,比利时认为西布曲明在大量人群中使用会导致血压升高和心率加快,且这种作用的长期后果缺少充分的证明文件。因此要求专利委员会(CPMP)对含西布曲明的治疗产品的效益/风险进行再评估。 2002 年 3 月,意大利决定暂停含西布曲明的治疗产品在意大利的上市许可,做出这个决定主要是基于安全性的考虑,因为有大量的关于西布曲明严重不良反应的报告,包括 2 例死亡。2002 年 10 月,欧洲委员会做出裁定,CPMP 所评估的数据未显示西布曲明的总体效益有所改变,西布曲明对治疗肥胖症是有效的;同时要求许可持有者尽快开展 “西布曲明心血管终点试验”(SCOUT)至少两年内每 6个月提交一次定期安全性更新表(PSUR),1 个月内通过致医生的信将产品特性摘要告知医生。
SCOUT研究是一项随机、双盲、安慰剂对照研究,始于2002年,长达6年。研究中不仅观察患者的体重减轻多少,还同时观察心血管事件的发生情况,如心脏病发作,中风和心脏骤停。在6年中共有大约 9800 名患者被随访。该项研究的数据安全监控委员会于2009 年 10 月向管理部门报告,初步的数据显示西布曲明的心血管风险高于安慰剂组。根据SCOUT研究的初步结果,各国政府纷纷采取相应的措施。英国在其网站发布信息,称基于欧盟的评估结果,要求企业停止西布曲明的销售。美国FDA发布了更新信息,称在评估了更多的数据后,要求企业在西布曲明的说明书中加入新的禁忌症,包括冠脉疾病、中风、短暂性脑缺血发作、充血性心力衰竭、心律失常等。澳大利亚TGA在其网站信息中称,根据SCOUT的研究数据,再次强调了西布曲明产品说明书中己有的建议。新添加了有关对SCOUT研究的描述信息和一项警告,即建议患者在使用西布曲明适当疗程后没有减肥效果则停止用药。TGA己要求企业发布了致医务人员的信,警告西布曲明相关风险。至今,西布曲明已经陆续在几个国家和地区撤市,但市场偶尔还能见到...
经典案例3:普纳替尼~抗癌药
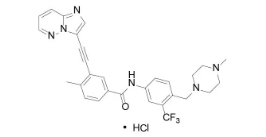
由Ariad Pharm开发,是一种多靶点酪氨酸激酶抑制剂(TKI),用于治疗对既往酪氨酸激酶抑制剂治疗耐药或不能耐受的有慢性相、加速相或母细胞相慢性粒性白血病(CML)或对既往酪氨酸激酶抑制剂治疗耐药或不能耐受的费城(Philadelphia)染色体阳性急性淋巴母细胞白血病(Ph+ALL);因普纳替尼(Iclusig®)疗效持久(91%的慢性期 CML 患者主要细胞遗传学反应会持续 12 个月),美国 FDA通过优先审评批准其上市销售。但距离普纳替尼加速审批还不到 1 年的时间(2013 年 10 月 31 日),FDA 宣布,鉴于与普纳替尼相关的“危及生命的血栓和血管重度狭窄”风险,FDA已经要求生产商暂停这种白血病治疗药物的销售和推广。这也是首个被撤市的小分子激酶抑制剂类抗肿瘤药。
针对于心血管安全,普纳替尼(Iclusig®)收集过如下数据:在使用 Iclusig 治疗的患者中,有8% (34/449)的患者发生了严重的动脉血栓;有 2% (8/449)的患者发生了严重的脑血管事件;有 2%(7/449)的患者发生了严重的外周动脉血管事件;3%发生静脉血栓事件;4%出现严重的充血性心力衰竭或左心室功能异常;67%的患者(300/449)出现治疗相关的突发性高血压;24%的患者发生出血性事件;1%因出现症状性心动过缓性心律失常需进行起搏器植入术;5%发生室上性快速心律失常...
但!!!由于慢性粒细胞白血病患者中部分为 T315I 基因突变型,而 T315I 基因突变对一、二代酪氨酸激酶抑制剂均产生耐药性,如达沙替尼与尼洛替尼。故普纳替尼成为唯一可以治疗 T315I 基因突变型慢粒患者的化疗药物。鉴于普纳替尼的不可替代性,2013 年 12 月,美国 FDA 在对其进行了风险效益评估,限制了适应证、添加了警示,在安全监控下再次批准其上市。但此次再上市的前提是普纳替尼只能应用于慢性粒细胞白血病患者,且为费城染色体阳性的急性淋巴母细胞白血病和对其他酪氨酸激酶抑制剂产生抗药性的患者。2015 年 12 月,FDA将使用该药可能引起血管闭塞,动脉闭塞和血栓形成加入普纳替尼的使用警告及注意事项,并指出在患者有严重或不稳定高血压的情况下,考虑中断使用普纳替尼。
小结
药物撤市,研发公司的损失是惨重的,人类的身体伤害也往往是不可逆的,其多方面的影响不言而喻;因安全性问题而撤市,有时伤害的也不仅仅是一个品种本身,往往是对一类药物的重新考核,有些被证实而更进一步(如塞来昔布),有些被质疑而原地不动(如依托考昔);心血管毒性,已日益受到药审部门的重视,研发人员不得不加以多多考究;日常工作中,须将各方面的风险因素进行加和,毕竟药学领域的一帆风顺,可以确定为“无”!
参考:
1. https://data.pharmacodia.com/web/home/index
2. Sciencedirect
3. CNKI
