来源:医药观澜
日前,业内传来消息,几日前被礼来80亿美元收购的Loxo Oncology公司的重磅“不限癌种”靶向药Vitrakvi(larotrectinib)已经在中国申报临床试验(IND),并获得受理。此时,距离该药获得美国FDA批准不到两个月,距离Loxo被礼来公司收购则刚刚一周时间。根据国家药监局药品审评中心(CDE)网站公开信息,该药品以“硫酸Larotrectinib胶囊”为名称的IND申请由拜耳公司申报,且已经于2019年1月14日获受理,受理信息如下:
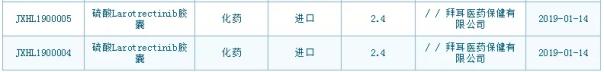
图片来源:CDE网站
Larotrectinib是Loxo Oncology公司和拜耳公司开发的新一代具备高度特异性的口服TRK抑制剂。该药的最大看点在于,它是一款针对特定基因突变,而不针对特定癌症种类的抗癌新药。其所能治疗的NTRK基因融合实体瘤包括乳腺癌、结直肠癌、肺癌、甲状腺癌等癌症类型。因此,Larotrectinib在美国获批被认为是癌症疗法从“基于癌症在体内的起源”转向“基于肿瘤的遗传特征”这一演变过程中的重要里程碑。该药早前已经获得美国FDA的突破性疗法认定,孤儿药资格和罕见儿科疾病认定,并于去年11月被FDA加速批准上市,用于治疗携带NTRK基因融合的成年和儿童局部晚期或转移性实体瘤患者,而不需考虑癌症的发生区域。
据悉,larotrectinib的临床试验采用了“篮子试验”(basket trial)的试验设计。即不按照患癌组织来募集患者,而是按照肿瘤的分子特征来募集患者。根据2018年10月欧洲肿瘤内科学会(ESMO)年会上公布的数据,在55名可以用RECIST标准衡量的TRK融合癌患者中,larotrectinib能够达到80%的客观缓解率(ORR)。而且,其在多种癌症类型中的表现都非常一致。
Larotrectinib在中国申报临床并获得受理,是该药在全球进行注册的又一大进展。希望这款新药能够尽快在中国开展临床试验,也希望临床研究顺利开展,早日为中国需要的癌症患者带来新的疗法。
参考资料:
[1]刚刚!FDA加速批准不限癌种靶向疗法,治疗NTRK融合肿瘤. Retrieved Jan 14, 2019, from 药明康德官微
[2]国家药监局药品审评中心(CDE)网站. Retrieved Jan 14, 2019, from http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=3
