据美国国立卫生研究院(NIH)统计,在美国有3000万名非酒精性脂肪肝(NASH)患者,这代表着巨大的未满足医疗需求。NASH目前没有获批疗法。目前有四家公司治疗NASH的在研药物接近了递交新药申请的终点线。2019年,NASH疗法开发领域值得关注,因为吉利德科学(Gilead Sciences),GenFit和Intercept Pharmaceuticals公司的3期临床数据即将公布。今天的这篇文章里,我们将和读者介绍NASH在研疗法的近况。
多项3期临床试验即将公布结果
吉利德科学的selonsertib的3期临床数据预计将在2019年第一季度公布。Selonsertib是一种细胞凋亡信号调节激酶1(ASK1)抑制剂。ASK1是在氧化应激环境下促进炎症、细胞凋亡和纤维化的一种蛋白。氧化应激在健康状况下通常水平比较低,但是在很多病理情况下会升高,例如NASH。Selonsertib目前在名为STELLAR 3和STELLA 4的两项3期临床试验中接受检验,如果结果积极,吉利德科学可能在今年下半年递交新药申请,在2020年可能获批。
奥贝胆酸(obeticholic acid, OCA)是Intercept公司的Ocaliva疗法的有效成分。OCA是一种胆酸的类似物,它能够与类法尼醇X受体(FXR)相结合,参与胆酸代谢和胆固醇代谢等重要代谢过程。它在2016年已经获得FDA批准用于治疗原发性胆汁性胆管炎(PBC)。Intercept希望能够将这款药物的适应症扩展到NASH。OCA目前正在名为REGENERATE的3期临床试验中接受检验,治疗尚未出现肝硬化的NASH患者。试验结果有望在2019年第一季度公布。
法国生物技术公司GenFit的在研药物elafibranor的3期临床结果可能会在2019年末公布。Elafibranor是一款PPARα/δ双重激动剂,PPARα/δ是调控机体新陈代谢方面的重要转录因子,在脂肪代谢和胰岛素抗性方面都有重要作用。
艾尔建(Allergan)公司的cenicriviroc是一款强力免疫调节剂,它能够阻断趋化因子受体CCR2和CCR5的功能。而这两个受体在NASH的炎症和纤维化信号通路中起到重要作用。根据clinicaltrials.gov的数据,这款疗法的3期临床试验AURORA的结束时间在2020年9月。
FDA最近发布了对NASH药物开发的指导草案。该指导草案对NASH疗法的3期临床试验的主要终点做出了建议。由于NASH的疾病进展缓慢,所以依靠疾病发展到肝硬化的时间或者患者生存期等传统临床终点的临床试验将会耗费很长时间。因此,FDA认为可以使用肝脏组织学特征来作为预测临床疗效的替代终点。FDA建议的替代终点包括:
1. 在组织病理学水平上脂肪肝炎消失(resolution of steatohepatitis),并且肝脏纤维化程度没有进一步恶化。脂肪肝炎消失被定义为没有脂肪肝病或者存在脂肪变性,但是没有脂肪肝炎。NAS评分在炎症方面为0-1,肝细胞气球样变(hepatocellular ballooning)方面为0, 脂肪变性方面可以为任何评分。
2. 或者肝脏纤维化程度改善超过1级(依照NASH CRN 纤维化评分),并且脂肪肝炎没有恶化(定义为NAS评分在炎症、肝细胞气球样变和脂肪变性方面没有增加)。
3. 或者同时达到肝脏纤维化程度改善和脂肪肝炎消失。

▲NASH后期临床试验信息一览
有趣的是,上述四家公司的3期临床试验在试验主要重点的设计上有很大的不同。吉利德科学的STELLAR 3和4试验,以及艾尔建的AURORA试验的主要终点均为改善肝脏纤维化,同时脂肪肝炎没有恶化(FDA建议的第2项替代终点)。而Genfit的RESOLVE-IT试验的主要终点为脂肪肝炎消失,同时肝脏纤维化程度没有恶化(FDA建议的第1项替代终点)。Intercept的REGENERATE试验包含了两个共同主要终点,分别为肝脏纤维化的改善和脂肪肝炎消失(FDA建议的第3项替代终点)。
这些试验终点的不同设计一定程度上意味着不同在研疗法的适用患者群将会有所不同。 NASH患者最初的症状包括脂肪变性、炎症和肝细胞气球样变,而这些症状的进一步发展,对肝脏组织反复造成损伤,会导致肝脏纤维化的产生。
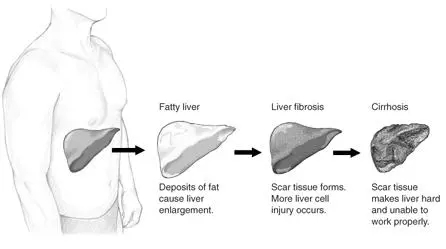
从左到右:正常肝脏→脂肪肝(脂肪沉积导致肝脏肿大)→肝纤维化(肝脏疤痕组织形成,肝细胞损伤增多)→肝硬化(肝脏变硬,功能受损)(图片来源:NIH)
对于已经产生肝脏纤维化的NASH患者来说,逆转肝脏纤维化是非常重要的治疗目标,因为肝脏纤维化的继续进行会导致肝硬化和肝功能的永久性丧失。艾尔建和吉利德科学的在研药物都以缓解肝纤维化为主要重点。
另一方面,由于NASH的最初症状是导致肝脏纤维化的主要原因,那么以消除脂肪肝炎症状为目标的疗法也可以防止新的纤维化的产生。Genfit的PPARα/δ激动剂elafibranor的主要作用是消除脂肪肝症状,理论上它可以对处于不同阶段的NASH患者都提供益处。
NASH疗法临床试验需要面对的挑战
所有开发NASH疗法的公司都需要解决与临床试验相关的一些问题,才能让NASH疗法的临床试验进行得更为顺利。例如,目前对NASH的确诊需要使用肝脏活检,这种具有创伤性的诊断方式可能让患者不愿意加入临床试验。目前,不少公司致力于开发利用医学成像或者血检技术进行NASH的诊断。
阻碍NASH患者加入临床试验的另一个原因是NASH早期没有明显症状,因此,加入临床试验的患者可能无法体验到症状的减轻,然而在研药物的潜在副作用却可能让患者不愿意加入临床试验。这并不是NASH疗法独有的挑战,任何在发病前症状轻微的“沉默”疾病在临床开发时都会遇到招募患者困难的问题。
迎接一波获批疗法
今年的摩根大通健康医疗(JPM)年会上虽然没有出现关于后期NASH在研药物的数据更新,但是不同医药公司的高管对NASH领域的发展提供了他们的展望。
吉利德科学研发负责人John McHutchison博士表示,他认为这一领域将迎来一波获批疗法。最初获批的疗法可能是治疗携带晚期肝脏纤维化患者的强效疗法,随后,治疗严重程度较低的NASH患者的疗法可能面世,它们可能有更好的安全性和耐受性特征。由于NASH疾病的复杂性和不同患者可能患有严重程度大不相同的疾病,这一领域可以容纳多款获批疗法。
“我们知道可以靶向不同的靶点,利用不同的生物学机制来治疗NASH,然而我们还不确定如何将这些疗法进行组合,从而对NASH患者产生最好的疗效。这是我们正在探索的方向。”McHutchison博士说。
组合疗法将是各家医药公司探索的主要方向。吉利德科学将检测selonsertib与调控脂肪酸代谢或胆酸合成的药物联用的疗效。艾尔建和诺华(Novartis)在2017启动合作研究cenicriviroc和一种FXR激动剂联用的效果。GenFit公司的首席运营官Dean Hum博士表示,该公司预计将使用elafibranor作为一线单药疗法,随后将使用该药作为组合疗法的基石。在JPM,Intercept公司宣布与Aralez Pharmaceuticals公司达成合作,将使用该公司的bezafibrate与OCA联用治疗PBC或其它肝脏疾病。
我们预祝在2019年NASH药物研发领域能够捷报频传,创新疗法能够更早被递交到患者手中。
参考资料:
[1] At JPM, the NASH flood gates start to crack. Retrieved January 14, 2019, from https://www.biopharmadive.com/news/nash-2019-jpm-readouts-deals-market-competition/545772/
[2] New Data from CENTAUR Phase 2b Clinical Study Supports Continued Development of Cenicriviroc (CVC) in Ongoing Phase 3 AURORA Trial. Retrieved January 14, 2019, from https://www.allergan.com/news/news/thomson-reuters/new-data-from-centaur-phase-2b-clinical-study-supp
[3] GENFIT: Positive Phase 2 Results from Study of Elafibranor in Primary Biliary Cholangitis. Retrieved January 14, 2019, from https://globenewswire.com/news-release/2018/12/06/1662790/0/en/GENFIT-Positive-Phase-2-Results-from-Study-of-Elafibranor-in-Primary-Biliary-Cholangitis.html
[4] Noncirrhotic Nonalcoholic Steatohepatitis With Liver Fibrosis: Developing Drugs for Treatment Guidance for Industry. Retrieved January 14, 2019, from https://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM627376.pdf
