日前,诺华公司公布了2018年第四季度和全年的财政报告。在回顾公司在2018年的表现之外,诺华的多位高管也展望了公司在2019年和未来可能达到的研发里程碑。在2017年,诺华公司投资90亿美元用于药物研发,是生物医药领域投资研发最高的医药公司之一。根据该公司首席执行官Vas Narasimhan博士的介绍,诺华在2019和2020年可能推出10余款潜在重磅药物。下面我们来看看诺华的药物研发管线中哪些药物可能在今明两年为患者造福。
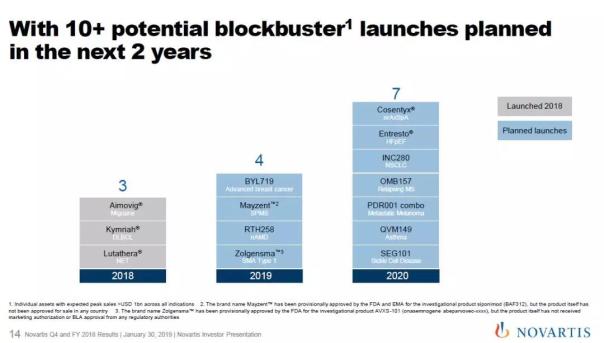
▲诺华2018年推出和2019/2020年计划推出的潜在重磅药物(图片来源:参考资料[9])
2019年有望推出的重磅药物
Alpelisib(BYL719)
Alpelisib是一款口服α亚型特异性PI3K抑制剂。它能够强力抑制PI3K信号通路,从而达到抑制肿瘤细胞增生的效果。而且携带PIK3CA突变的乳腺癌细胞对这一抑制剂尤其敏感。大约有40%的HR+/HER2- 晚期乳腺癌患者携带PIK3CA突变,这些突变激活PI3K的α亚型。这类患者通常预后不良,目前没有针对她们的靶向疗法。在去年公布的3期临床试验表明,alpelisib与氟维司群(fulvestrant)联用可以将携带PIK3CA突变的乳腺癌患者的无进展生存期(PFS)提高一倍(11个月比5.7个月)。这款新药预计在2019年下半年推出。

图片来源:参考资料[9]
Mayzent(Siponimod, BAF312)
Siponimod是一款S1P受体特定亚型的调控剂。它能够与淋巴细胞中的S1P1亚型受体相结合,防止它们进入多发性硬化症(MS)患者的中枢神经系统,从而达到抑制炎症的效果。它用于治疗继发进展型多发性硬化症(SPMS)的新药申请已经在去年被FDA接受。在名为EXPAND的3期临床试验中,siponimod能够将SPMS患者6个月内残疾进展风险降低26%(p=0.0058),将脑容量减少速度降低23%(p=0.0002)。这款新药可能是第一款延缓SPMS患者残疾进展的改变疾病进程疗法。它有望在2019年同时在美国和欧盟推出。
Zolgensma(AVXS-101)
这是一款用于治疗1型脊髓性肌萎缩症(SMA)的基因疗法,旨在替换患者体内出现变异的SMN1基因,从而一次治疗就可长期缓解,甚至治愈这一严重遗传病。在名为START的临床试验中,接受治疗的儿童都达到了通常SMA患者无法达到的发育里程碑。这款疗法的申请去年已经被FDA接受并且被授予优先审评资格。预计在2019年上半年在美国和日本获批,在2019年中在欧盟获批。诺华同时计划在2019年的美国神经病学学会年会上公布这一疗法在治疗2型SMA患者方面的积极数据。
RTH258(brolucizumab)
Brolucizumab是一款人源化单链抗体片段(scFv),能够抑制所有的VEGF-A亚型,从而抑制VEGF信号通路介导的血管增生。它用于治疗新生血管性年龄相关性黄斑变性(nAMD,又称为湿性AMD)。最近公布的3期临床试验结果表明,brolucizumab与常用nAMD疗法相比,在减少患者视网膜积液方面有更好的表现。这款疗法预计在2019年底推出。

图片来源:参考资料[9]
2020年有望推出的重磅药物
Cosentyx(secukinumab)
这款用于治疗中重度斑块状银屑病的IL-17A抑制剂已经获得FDA批准上市。诺华将致力于扩展改疗法的适应症范围,治疗银屑病关节炎、强直性脊柱炎和非放射性中轴脊柱关节炎患者。治疗这些适应症的关键性临床数据将在今年晚些时候公布,如果试验结果积极,诺华可能在年底之前提交监管申请。
Entresto(sacubitril/valsartan)
Entresto已经获得FDA批准用于治疗射血分数下降型心力衰竭(HFrEF,又名收缩性心力衰竭)患者。目前这一疗法在名为PARAGON-HF的3期临床试验中接受检验,治疗射血分数保留型心力衰竭(HFpEF,又名舒张性心力衰竭)患者。这是人数更多的一类心力衰竭患者。该项试验的数据预计在2019年第三季度公布。
INC280(capmatinib)
这是一款口服,特异性MET抑制剂。在治疗携带MET外显子14跳跃突变的非小细胞肺癌患者的2期临床试验中,它在未接受过治疗的患者中达到72%的总缓解率(ORR)。在已经接受过前期治疗的患者中达到39%的ORR。诺华计划在今年晚些时候递交监管申请。
OMB157(ofatumumab)
Ofatumumab是一款完全人源化的CD20抗体。它通过与B淋巴细胞表面的CD20结合,能够清除血液中B细胞,而这些细胞在多发性硬化症(MS)患者中对激发自身免疫反应有重要作用。Ofatumumab已经获得FDA批准作为白血病疗法,然而诺华认为这款药物可能可以用于治疗MS。目前它在两项3期临床试验中接受检验。
PDR001组合疗法
PDR001又名spartalizumab,是诺华公司开发的一款PD-1抑制剂。它目前在一项3期临床试验中,与dabrafenib和trametinib联用治疗携带BRAF V600突变的转移性黑色素瘤患者。预计试验的顶线结果将在2019年下半年获得。
QVM149
QVM149是一款固定剂量的复方产品,由长效毒蕈碱拮抗剂(格隆溴铵),长效β2受体激动剂(茚达特罗),和吸入皮质类固醇(糠酸莫米松)三种有效成分构成。目前在一项3期临床试验中用于治疗哮喘。这一临床试验有望在今年结束。
SEG101(crizanlizumab)

图片来源:参考资料[9]
这款用于防止镰状细胞贫血症(SCD)患者的血管闭塞性危象(VOCs)的在研疗法日前刚刚获得FDA授予的突破性疗法认定。在名为SUSTAIN的2期临床试验中,它能够将SCD患者每年因为VOCs导致需要就医接受治疗的次数减少了45.3%(p=0.01)。诺华预计在今年递交监管申请,有望在2020年推出这一新药。
图片来源:参考资料[9]
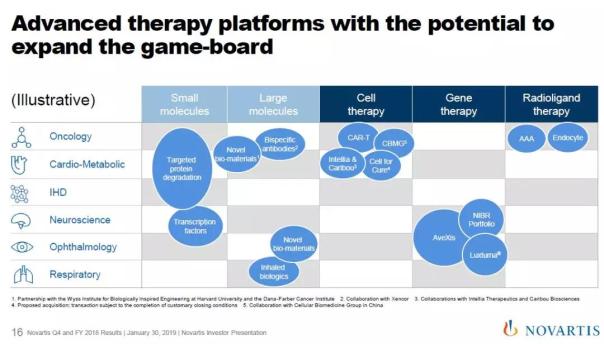
除了这些在近期可能推出的重磅疗法之外,诺华还将积极投资建立先进疗法平台,布局靶向蛋白降解,双特异性抗体,创新生物材料和放射性配体疗法等多种创新疗法的研发。该公司的基因疗法平台在2019年将有7个项目有望进入临床期。

图片来源:参考资料[9]
参考资料:
[1] Novartis investigational BYL719 (alpelisib) plus fulvestrant nearly doubles median PFS in patients with PIK3CA mutated HR+/HER2- advanced breast cancer compared to fulvestrant alone. Retrieved January 31, 2019, from https://globenewswire.com/news-release/2018/10/20/1624341/0/en/Novartis-investigational-BYL719-alpelisib-plus-fulvestrant-nearly-doubles-median-PFS-in-patients-with-PIK3CA-mutated-HR-HER2-advanced-breast-cancer-compared-to-fulvestrant-alone.html
[2] Novartis announces FDA filing acceptance of siponimod (BAF312), the first and only oral drug shown to delay disability progression in typical SPMS patients. Retrieved January 31, 2019, from https://www.pharma.us.novartis.com/news/media-releases/novartis-announces-fda-filing-acceptance-siponimod-baf312-first-and-only-oral
[3] Phase III data in The Lancet show Novartis siponimod significantly improves outcomes in patients with secondary progressive MS. Retrieved January 31, 2019, from https://www.novartis.com/news/media-releases/phase-iii-data-lancet-show-novartis-siponimod-significantly-improves-outcomes-patients-secondary-progressive-ms
[4] Novartis announces FDA filing acceptance and Priority Review of AVXS-101, a one-time treatment designed to address the genetic root cause of SMA Type 1. Retrieved January 31, 2019, from https://www.novartis.com/news/media-releases/novartis-announces-fda-filing-acceptance-and-priority-review-avxs-101-one-time-treatment-designed-address-genetic-root-cause-sma-type-1
[5] New analysis of Novartis Phase III brolucizumab (RTH258) data reinforces superior reduction of retinal fluid, a key marker of disease activity in nAMD. Retrieved January 31, 2019, from https://www.novartis.com/news/media-releases/new-analysis-novartis-phase-iii-brolucizumab-rth258-data-reinforces-superior-reduction-retinal-fluid-key-marker-disease-activity-namd
[6] New Novartis study supports Entresto as foundational HFrEF therapy and in-hospital initiation in appropriate stabilized heart failure patients. Retrieved January 31, 2019, fromhttps://www.novartis.com/news/media-releases/new-novartis-study-supports-entresto-foundational-hfref-therapy-and-hospital-initiation-appropriate-stabilized-heart-failure-patients
[7] Phase 2 GEOMETRY mono-1 Trial of Investigational Medicine Capmatinib Shows Positive Results in Patients with MET-mutated Advanced NSCLC. Retrieved January 31, 2019, from https://investor.incyte.com/news-releases/news-release-details/phase-2-geometry-mono-1-trial-investigational-medicine
[8] QVM149 (Novartis) Drug Overview 2018 - ResearchAndMarkets.com。 Retrieved January 31, 2019, from https://www.businesswire.com/news/home/20180514006238/en/QVM149-Novartis-Drug-Overview-2018---ResearchAndMarkets.com
[9] Novartis investigational therapy crizanlizumab (SEG101) receives FDA Breakthrough Therapy designation for the prevention of vaso-occlusive crises in sickle cell disease . Retrieved January 31, 2019, from https://www.novartis.com/news/media-releases/novartis-investigational-therapy-crizanlizumab-seg101-receives-fda-breakthrough-therapy-designation-prevention-vaso-occlusive-crises-sickle-cell-disease
[10] Novartis Q4 and FY 2018 Results. Retrieved January 31, 2019, from https://www.novartis.com/sites/www.novartis.com/files/q4-2018-ir-presentation.pdf
[11] Novartis lays out blockbuster launches for 2018-2020, with surprising inclusion of Kymriah. Retrieved January 31, 2019, from https://endpts.com/novartis-lays-out-blockbuster-launches-for-2018-2020-with-surprising-inclusion-of-kymriah/
