距2018年2月FDA拒绝Ozanimod上市已经一年,2019年3月11日,Celgene向EMA递交了其多发性硬化症新药Ozanimod的上市申请,并且将在3月底再次向FDA申请Ozanimod上市,有望成为Celgene的重磅炸弹,预计年销售额50亿美元左右。
Ozanimod是一款Celgene通过收购Receptos获得的多发性硬化症(MS)资产,是一种新型、口服、选择性鞘氨醇1-磷酸酯受体1(S1PR1)和受体5(S1PR5)调节剂,目前已成功完成临床III期试验。多发性硬化症(MS)一种中枢神经脱髓鞘疾病,按疾病进程可分为复发型(RMS)、原发进展型(PPMS)和进展复发型(PRMS)。
2019年3月11日,Celgene向EMA递交Ozanimod治疗RMS的上市申请,另外Celgene预计在3月底再次(2018年02月被FDA拒绝)向FDA申请Ozanimod上市的新药,适应症同样是RMS(占85%的MS患者)。
这两次上市申请基于两项关键III期临床试验,SUNBEAM和RADIANCE Part B,其是两项多中心、随机、双盲的III期临床试验,研究人员在2666名MS患者中评估了Ozanimod的疗效和安全性。临床数据表明,与一线治疗药物Avonex相比,1mg和0.5mg剂量的Ozanimod显著降低了患者的MS年复发率,同时也获得了良好的安全性数据。
在上述两项关键III期临床试验中,虽然接受评估的2659名患者中,1mg、0.5mg剂量的Ozanimod以及Avonex组3个月确证残疾进展的患者比例分别为7.6%、6.5%和7.8%,未达到统计学上显著差异,但经Ozanimod治疗后患者脑容量损失取得良好的数据。

Celgene将Ozanimod与Gilenya(Novartis)的临床数据进行交叉分析后,认为Ozanimod更具市场优势,虽然两者具有类似的疗效,但Ozanimod对肝脏的压力更小,展现出更好的安全性。如果获批,Celgene预计Ozanimod每年最高可取得40-60亿美元的销售额。
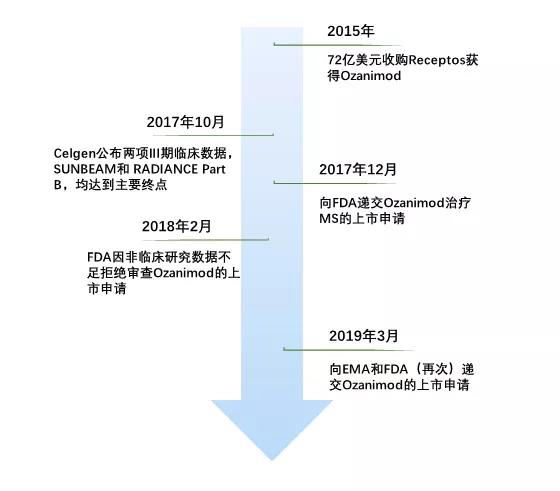
然而单靠优异的临床数据并不能保证顺利上市,2018年2月,Celgene收到FDA拒绝开展全面审查的通知,理由是Ozanimod的非临床和临床药理学证据不足。FDA的拒收信至少使Ozanimod推迟一年上市,按Celgene的估算其已经损失约50亿美元,此外Celgene的能力还受到股东们的质疑。
时隔一年,2019年3月,Celgene补充非临床研究以及对现有数据添加分析后,先后向EMA和FDA递交Ozanimod的上市申请,欲一举拿下两大市场,重新展现自己的实力。
Celgene的首席医疗官Jay Backstrom博士在声明中讲到,"Celgene相信,Ozanimod是同类中最好的、早期治疗RMS的口服药,我们期待监管部门的审查,以及Ozanimod在改善RMS患者生活质量的潜力。"
参考来源:
1.Celgene's MS drug ozanimod gets EU filing, with FDA submission to follow;
2.Celgene Submits Application to EMA for Ozanimod for the Treatment of Relapsing-Remitting Multiple Sclerosis;
原标题:《时隔一年,Celgene先后向EMA和FDA递交Ozanimod的上市申请》
