作者:KERR
1984年美国发布《药品价格竞争与专利期补偿法案》,即Hatch-Waxman法案,通过数据独占性和专利期限相结合,提供创新药物长达14年的市场保护,平衡创新和市场竞争。近些年,仿制药审批和市场份额渗透率达到了创纪录数字,多数创新药确定了稳定的排他性时间,但这些数据也部分掩盖了行业对品牌制药公司使用各种策略维持“常青树”产品和“专利延迟”的指控。
虽然如此,美国仿制药市场经过这35年的发展还是全球第一的规模,相比于中国近几年开展一致性评价对仿制药行业的重新洗牌和重塑,美国仿制药市场的现状和问题,对我国仍有不少借鉴之用,新浪医药就在此展开一些分析。
超越专利壁垒 仿制药市场份额逐年增加
事实上在过去20多年来,美国仿制药上市所需的时间一直保持在13.5年左右。而且,一旦进入市场,仿制药就会以前所未有的速度获得巨大的市场份额。这也是为何原研药企业以专利叠加、协议延后上市等各种手段,极力拖延仿制药进入市场的原因。
新浪医药曾报道,辉瑞为了抵御其全球最畅销镇痛药Lyrica(pregabalin,普瑞巴林)面临仿制药的竞争,为该药注册了68项专利。而后,为了进一步阻碍仿制药上市的市场竞争,又推出了一种专利的持久配方,并大力引导患者使用新药。在此过程中,辉瑞非但没有因为仿制药上市而降价,相反借由新产品的推出将药品价格提高了163%。艾伯维也是如此,为了维持其全球明星产品Humira(阿达木单抗)的销量,共申请了多达247项专利。并且通过与安进、三星Bioepis和迈兰达成和解,将Humira生物仿制药进入美国的时限延迟至2023年。也就是说,艾伯维利用专利保护确保了Humira在2020年销售额达到210亿美元。(详见:为专利各出招 艾伯维、罗氏和辉瑞被指滥用制度获巨额利润)
尽管行业内对于原研药专利申请过多的指控不绝于耳,但2016年《医学经济学杂志》给出的数据显示,全球获批的新药只有少部分有橙皮书列出的专利;平均每种药物只有2.5项“第二”专利,而且超过75%的第二项专利是在原研药被FDA批准之前提交的,因此并非“老药申请新专利”。像Lyrica、Humira这样的专利霸占产品仍属于少数,但由于其畅销,因此有能力的大型企业会不竭余力地保留其市场份额。
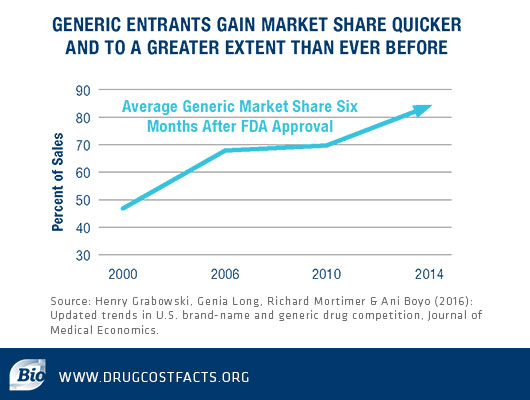
近20年,仿制药上市后获得市场份额的速度更快,并且比以前拥有更大的扩展范围。2014年美国数据显示,FDA批准上市6个月后,仿制药的平均市场份额就能超过80%。
实际上,美国监管部门一直在进行改革,包括修改药物有关条款,以激励和加速仿制药和生物仿制药的进入。2017年21世纪治愈法案和FDA再授权法案,以及FDA继续采取的行政行动,均为消除仿制药申请过程的积压问题。2019年2月15日,FDA又发布一条新的审批路径——竞争性仿制疗法途径(简称CGT),加速开发和审批缺乏竞争药品的仿制药,作为美国增加药品竞争和降低药品价格努力的一部分。(详见:FDA发布仿制药审批新途径:药物将获180天独家经营权)
过去几年,美国仿制药申请的批准数量逐年稳步增长,政策改革已经将仿制药审批数量推向历史性的新水平。
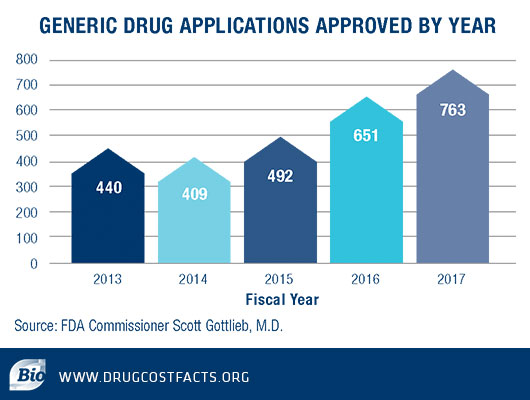
FDA局长Scott Gottlieb曾在2018年1月3日表示,“FDA还将继续采取行动,使品牌公司更难采取各种策略阻止仿制药按法律规定的时间进入市场的。该机构已优先考虑2018年改进指导,以解决旨在防止或延迟仿制药进入市场的恶劣商业活动。”
最终2018年美国FDA突破性地批准或暂时性批准了1021份新药简化申请(ANDAs),其中复杂仿制药占14%;首仿药占10%。(详见:2018美国FDA仿制药批准报告:批准超1000个仿制药 首仿药占10%)
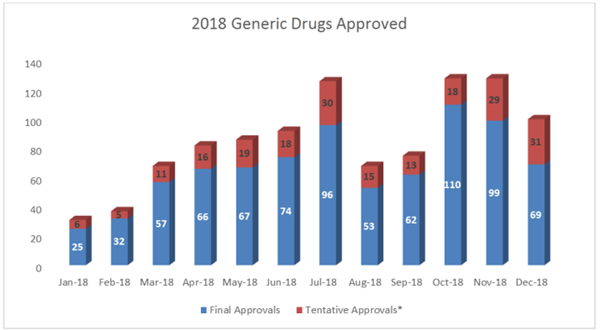
2018年仿制药审批情况:暂时性批准211项,完全批准810项
美国仿制药处方占有率达到89%
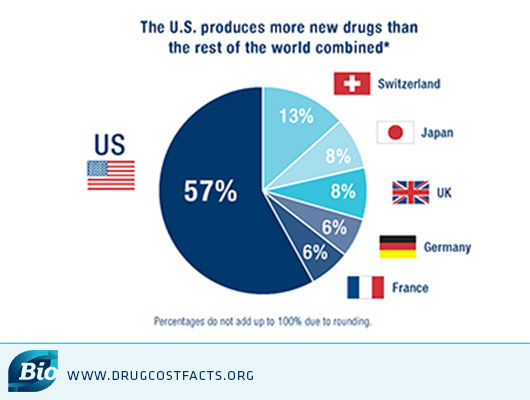
在发达国家中,美国始终不仅在创新方面处于世界领先地位,而且还拥有最强大的仿制药市场。美国生产的新药比世界其他地方的新药物总合还多,2014年其上市的新药占全球的57%。而且创新热潮也在推动仿制潮向前,两者并行不悖。
据《2018年中国仿制药行业现状及行业发展趋势分析》显示,2016年全球仿制药市场规模达到2200亿美元,美国是全球最大的仿制药消费国,2016年美国市场仿制药销售总额约为800亿美元。预计未来几年,美国仿制药市场年复合增长率将达到9.1%,2020年仿制药销售额将突破1100亿美元。
而且美国仿制药的处方占比也是全球最高的。2017年,仿制药占美国全部处方量的89%,其次是英国83%。而我们的邻国日本,只有34%。低价仿制药的普及给美国医疗卫生体系带来了可观的开支节约。

资料来源:美国药品可及性协会、经合组织(OECD)2017年卫生统计数据
仿制药审批拖延 质量是全球市场关注重点
2017年美国FDA曾指出,仿制药市场面临的主要挑战在于仿制产品首次申请上市的获批比例太低。对于普通药物制造企业来说,其仿制药是不太可能在第一轮申请时就获得批准的。数据显示,在首次申请时,仅9%的仿制药获得批准,而新药则有90%以上获批。

生物技术创新组织BIO认为,改善药物竞争的最佳方式是在现有政策的基础上,加快FDA批准首次申请的仿制药。FDA局长Gottlieb则表示,“刺激药物市场出现更多竞争的关键是改善仿制药质量不佳的问题。”
我国仿制药随一致性评价重塑
2018年数据指出,我国总体仿制药市场规模达到5000亿元左右,占总药品消费市场的约40%,占比仍相对较低。此前,我国药品批准文号总数高达18.9 万个,其中95%以上为仿制药,而且在3244个化学药物品种中,262个主要品种占据了注册文号总量的70%。
但是行业集中度非常低。中国仿制药行业集中率(CR8)占比仅18.82%,而印度CR8 占比52.31%、美国CR8 占比52.96%。仿制药批文多但企业产能不集中,导致我国市场出现大量低水平的重复建设,同质化竞争和恶性价格战,使得我国医药产品产能利用率非常低。此前有统计显示,我国仿制药行业平均毛利率仅5%-10%,远低于国际50%的平均水平,行业盈利能力差。而且仿制药疗效与原研药差距大,也出现了原研药在专利过期后还能在中国市场销量上升的奇特现象。
我国医药产品产能利用率
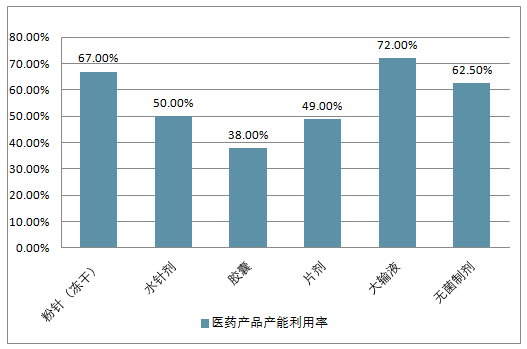
资料来源:公开资料整理
因此,国务院在2016年2月6日发布了《关于开展仿制药质量和疗效一致性评价的意见》,对国家基本药物目录(2012年版)中2007年10月1日前批准上市的化学药品仿制药口服固体制剂按照与原研药品质量和疗效一致原则开展评价,不仅为了我国保障药品安全性和有效性,也在于促进医药产业升级和结构调整,增强国际竞争能力。
截止3月20日,国家药审中心(CDE)受理的一致性评价受理号已经达到1000个(按照补充申请计,下同),涉及332家企业的304个品种,其中已有167个受理号(80个品种)通过一致性评价。其中江苏恒瑞医药股份有限公司申报的一致性评价药品数量高居各企业申报数量榜首,达22个受理号;其次是正大天晴药业集团股份有限公司,19个受理号。通过目前全国申报一致性评价受理的企业来看,多为国内第一阶梯的大型药企,综合实力较强,以往仿制药占企业的营收比例也较大。
但一致性评价开展至今,也仍存在部分企业经济实力薄弱、愿意和能够承担生物等效性试验的临床试验机构数量不足、部分仿制药的参比制剂仍未公布等现实问题,很多企业实际上是无法开展一致性评价工作的,药品批号面临作废。有中小企业负责人表示,药品一致性评价政策导向是好的,但应遵循国内企业发展规律推进,不应一刀切,导致企业为一致性评价而评价,耗费大量社会资源,违背市场规律。政策细则出台的拖延,也严重打击了不少企业的积极性。企业需要公平,对相应政策先行的企业应有特殊审批渠道,不应又一刀切或置之不理。
这也是为何全国人民代表大会代表、江苏恒瑞医药董事长孙飘扬今年在两会期间呼吁,“我国仿制药政策应继续稳妥推进,确保仿制药质量可靠,价格合理,供应充足。支持民营企业、品牌仿制,并鼓励仿制药走出去参与国际市场竞争。”
业内人士对新浪医药表示,仿制药一致性评价立意是好,对我国仿制药市场长期以来“小、散、乱”的局面也将一定程度扭转,但政策执行和落实过程中还应增加与各省市、各类型药企的沟通,全面收集行业意见。
但对我国仿制药行业可以预见的是,未来低壁垒仿制药的份额会缓慢下降,最终去产能化,带动行业集中度提高。高壁垒仿制药份额逐渐上升,优质品种获得更广阔的市场空间。
