作者: 符苏
目前,CAR-T疗法在治疗白血病、淋巴瘤等血液癌症方面表现出积极的疗效。科学家们一直试图努力在实体瘤中复制CAR-T对抗血液癌症的业绩。但是,这一应用却面临着多重阻碍——与白血病、淋巴瘤不同,实体瘤更具有异质性,且会表达更多的肿瘤蛋白(这会增加CAR-T细胞准确靶向肿瘤的难度)。
“肿瘤组织中的细胞并不是都表达相同的肿瘤蛋白,所以仅仅只靶向一种蛋白质可能会限制CAR-T疗法的功效。”贝勒医学院的Shoba Navai解释道,“此外,大的肿瘤组织会对T细胞的进入造成物理障碍。”同时,实体瘤更倾向于在对抗T细胞中的环境中生长,这会抑制免疫细胞发挥效用。
即便困难重重,科学家们并没有放弃努力。在最新举办的2019年度美国癌症研究学会年会(AACR)上,来自Memorial Sloan Kettering(MSK)癌症中心和贝勒医学院的研究团队分别报告了CAR-T疗法在治疗一些晚期实体瘤(间皮瘤和肉瘤)上的潜力。
靶向间皮素的CAR-T疗法
在由MSK 癌症中心的胸外科副主任Prasad Adusumilli领导的研究中,共21名患有恶性胸膜疾病的患者(其中有19位患有间皮瘤,一位是转移性肺癌、另一位是转移性乳腺癌)接受了CAR-T治疗。结果显示,这可能是一种更有效的治疗策略。
间皮瘤是一种与石棉暴露有关的恶性实体瘤,预后效果特别差。2003年,铂类化疗药物组合获批用于治疗这一肿瘤,当时的中位生存期只有约3个月。此外,包括默沙东的Keytruda(pembrolizumab)等在内的免疫检查点抑制剂的早期试验仅仅表现出轻微的反应率。
Prasad Adusumilli团队设计的CAR-T(IcasM28z)靶向一种多数癌细胞表面都会表达的蛋白——间皮素(mesothelin)。这些细胞还添加了Icaspase-9“安全自杀”开关,一旦在患者体内发生意外毒性,这个开关会被启动从而消灭所有的CAR-T细胞。
在化疗预处理后,研究人员将CAR-T细胞注入患者胸膜腔中。38周后,有13名患者的外周血中依然可以检测到CAR-T细胞,并且它们的存在与血液中间皮素相关肽水平降低50%以及肿瘤消退有关。
除了CAR-T,研究团队还进行了PD-1的联合疗法,因为临床前研究显示,面对实体瘤,CAR-T疗法会出现“T细胞疲倦”的现象,而PD-1抗体可以重新激活这些细胞,并在小鼠试验中显现出根除肿瘤的效果。
在接受CAR-T和至少三个周期的抗PD-1治疗的11名患者中,有8名患者的肿瘤缩小。其中有两名患者在60周和32周时一直对治疗有完全的缓解反应。
重要的是,临床试验并没有出现CAR-T细胞相关毒性高于2级的现象,而且没有患者发生神经毒性或者细胞因子释放综合征(CAR-T细胞疗法的常见副作用)。
Prasad Adusumilli表示,这是一项早期临床试验,对于CAR-T的长期疗效依然尚未确定。但是已有数据依然让人兴奋。而且,联合疗法并没有让每个人都受益:21名患者中有12名最终依然出现了癌症发展的情况。
目前,MSK癌症中心已经将靶向间皮素的CAR-T技术授权给一家位于加利福尼亚州南旧金山的生物技术公司Atara Biotherapeutics,用于进一步研究。
靶向HER2阳性肿瘤:有抗癌活性
来自贝勒医学院的Meenakshi Hegde和Shoba Navai团队则是测试了靶向HER2的CAR-T疗法。结果同样让人欣慰。
HER2是一种在许多不同的实体肿瘤类型中发现的蛋白质,最典型的莫过于乳腺癌,HER2阳性的肿瘤转移的风险相对更高。对于复发性或者难治性肉瘤患者而言,可以选择的治疗手段相当有限。
Meenakshi Hegde团队之前的研究已经证实,相比于曲妥珠单抗,靶向HER2的CAR-T细胞能够更好的靶向表达低水平HER2的肿瘤细胞。
在Ⅰ期试验中,研究团队共招募了10名患有难治性或转移性HER2阳性肉瘤患者(其中5例患有骨肉瘤,3例患有横纹肌肉瘤,1例患有尤文肉瘤和1例滑膜肉瘤),他们接受了多达3次的CAR-T细胞注射。
结果显示,有8位患者体内的CAR-T细胞在第7天出现中位峰值扩增,并且他们可以在输注后6周检测到CAR-T细胞。其中,一位横纹肌肉瘤患者(已经转移至骨髓中)在接受CAR-T治疗后出现了12个月的缓解期,但是后来依然复发了。同样,这项研究也没有出现神经毒性,但是有2名患者出现了细胞因子释放综合征(风险大于2级)。
研究人员表示,相比于治疗血液癌症的CAR-T细胞,靶向HER2的CAR-T细胞治疗能力更为有限。他们需要更多的患者,进行更多的验证,以确定疗效和最佳剂量。
抗癌之路任重道远
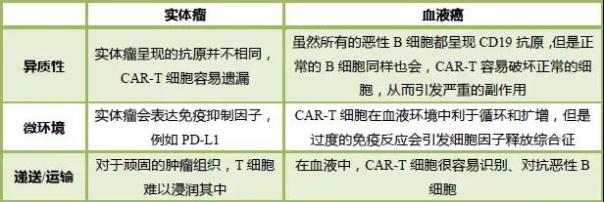
事实上,无论是实体瘤还是血液癌,CAR-T疗法都存在挑战(表格信息参考自The Scientist:CAR-T Cells in Solid Versus Liquid Cancers)
包括GSK、TCR2 Therapeutics和Ziopharm在内的几家制药公司都已经转向CAR-T的“表亲”——T细胞受体疗法(T cell receptor,TCR),同样是利用患者自身T细胞治疗癌症,但是与CAR-T细胞识别抗原的机制完全不同。
参考《Nature Biotechnology》期刊的上一篇综述,TCRs利用α和β肽链构成的异元二聚体(heterodimer)来识别由主要组织相容性复合体(major histocompatibility complex,MHC)呈现在细胞表面的多肽片段。CARs则利用能够与特定抗原结合的抗体片段来识别肿瘤细胞表面的抗原。
考虑到MHC分子能够呈现从细胞表面和细胞内蛋白中获得的肽链,所以与CARs相比,TCRs理论上能够靶向更多的抗原。但是,围绕这两种抗癌技术在实体瘤中的应用还处于早中期,CAR-T疗法还有很多的困难需要克服,例如约30-50%的患者在治疗后出现癌症复发,10-20%的患者无法进入缓解期等。
参考资料:
1)Early studies hint at some potential for CAR-T therapy in solid tumors
2)Mesothelin-targeted CAR T-cell therapy shows early promise in patients with solid tumors
3)Mechanisms of resistance to CAR T cell therapy
4)Driving T-cell immunotherapy to solid tumors
5)HER2-targeted CAR T-cell therapy shows promising antitumor activity in patients with sarcoma
