作者:禾禾
6月13日,Mylan宣布收到了FDA关于其仿制版Advair Diskus(氟替卡松沙美特罗)上市申请的完全回复信(CRL)。FDA在CRL中指出Mylan的产品存在轻微缺陷(minor deficiencies)。Mylan并未对外披露这个“轻微缺陷”的详细信息,须在6月27日之前向FDA做出回复。
Mylan最早在2016年2月19日率先提交氟替卡松沙美特罗吸入粉剂的ANDA,但FDA在2017年3月28日的GDUFA预定审批期限内做出拒绝的决定。此后,FDA又在2017年5月11日拒绝批准了Hikma制药的VR315(氟替卡松沙美特罗)的ANDA,在2018年2月8日拒绝批准了Sandoz的ANDA。
虽然,FDA也在2017年1月30日批准了Teva的AirDuo RespiClick(氟替卡松/沙美特罗)上市,但GSK发言人对于这个与Advair Diskus成分完全相同的药物并不感冒,当即表态称:“AirDuo 与Advair之间并不是可替换的关系,在治疗上也无法达到与Advair 等效……”
总之,尽管2011年化合物专利到期,2013年9月FDA专门出台仿制指南,2016年干粉吸入装置专利保护到期,Advair Diskus至今还没遭遇到真正的仿制药威胁。从销售曲线上看,Advair Diskus也不像其他失去专利保护后的化药一样跌下专利悬崖。可以说,吸入制剂的技术壁垒(尤其是吸入装置)让Advair Diskus做到在呼吸疾病市场独霸一方。
Seretide/Advair 历年全球销售额(百万英镑)
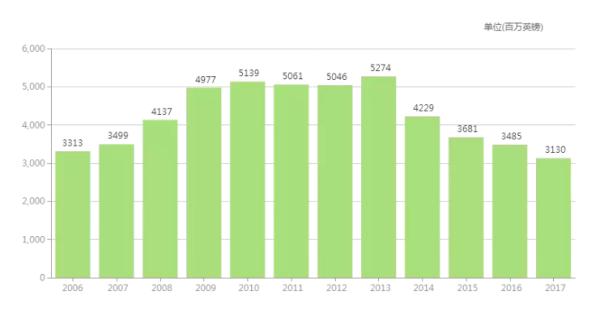
来源:医药魔方全球新药库
Advair是一款治疗哮喘和慢性阻塞性肺病(COPD)的经典药物,盘踞全球畅销药TOP10多年。哮喘和慢性阻塞性肺疾病(COPD)是全球范围内最常见的两类呼吸科疾病,影响数亿患者。哮喘可发病于任何年龄段,我国大约有3000万哮喘患者。COPD在全球40岁以上成人中的发病率已达10%左右,我国大约为8%。
随着中国居民支付能力的提升,以哮喘和COPD为代表的国内呼吸疾病药物市场还有很大的扩张空间,对于Advair专利到期后的市场,国内制药企业也是觊觎已久。不过呼吸制剂的技术难度较高,而且个体吸收差异较大,BE试验很难拿到与原研生物等效的结果,因此注册法规一般要求开展PK研究和桥接临床试验,因此国内有实力参与开发的玩家并不多,称得上是巅峰较量。
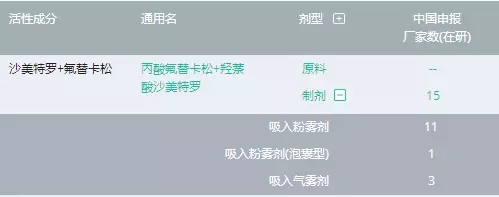
如果去除一些注册失败的厂家,国内企业在开发氟替卡松沙美特罗吸入粉雾剂(不包括气雾剂)的不过以下5家。其中,京卫制药获批临床后还未见登记启动试验;恒瑞医药在2016年10月15日公告拿到临床批件,临床前研发投入已经高达3048万元,在2017年2月4日公示启动了一项300人的与Advair的头对头研究(CTR20170153),目前还在进行中,尚未申报上市;正大天晴先后登记了3项临床试验(其中包括1项BE试验),目前已按照新4了申报上市,处于在审评审批阶段。
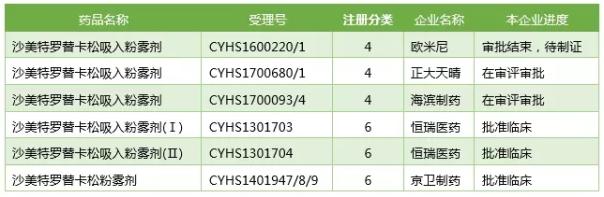
比较有意思的是,一家专门开发高端吸入制剂的初创公司欧米尼在这场巅峰较量中悄无声跑到了前头,未见登记临床试验,但已经按照4类申报上市,并且目前的状态是“审批结束,待制证”。
最后的问题来了,欧米尼的沙美特罗替卡松吸入粉雾剂会是第一个获批的Advair仿制药吗?
