影响众多药企的上市许可持有人制度要来了!
昨日(7月17日),国家药监局就上市许可持有人制度再次发函。回复了上市许可持有人和生产企业各自的权责问题。
据悉,上市许可持有人制度试点将实施至2018年11月4日,随后将在完善后全国推广。也就是说,4个月之后,上市许可持有人制度的下一步走向就将明确。
据清华大学法学院教授王晨光撰文,药品上市许可持有人制度是我国药品注册制度的新核心,将对我国医药产业从研发到监管产生深刻影响。
▍药品上市许可持有人制度
药品上市许可持有人制度,在我国开始于2015年。
2015年11月4日,第十二届全国人民代表大会常务委员会第十七次会议“授权国务院在北京、天津、河北、上海、江苏、浙江、福建、山东、广东、四川十个省、直辖市开展药品上市许可持有人制度试点,允许药品研发机构和科研人员取得药品批准文号,对药品质量承担相应责任。”
随后,国务院于2016年6月6日正式发布《药品上市许可持有人制度试点方案》(国办发〔2016〕41号,以下简称《方案》)。
据悉,上市许可持有人制度是修订后的《药品管理法》的核心制度之一,进而在我国药品领域全面推广实施。我国药品注册制度将形成以药品上市许可持有人制度为中心的新制度。
与欧、美、日等药品产业发达国家和地区不同,在我国现行药品注册制度是上市许可与生产许可“捆绑制”的管理模式,也就是说,药品上市许可(药品批准文号)只颁发给具有《药品生产许可证》的生产企业,药品研发机构、科研人员则不具备独立获取药品上市许可的资质。
而所谓药品上市许可持有人制度,通常指拥有药品技术的药品研发机构、科研人员、药品生产企业等主体,通过提出药品上市许可申请并获得药品上市许可批件,并对药品质量在其整个生命周期内承担主要责任的制度。
▍明确责任主体,释放研发活力
在该制度下,上市许可持有人和生产许可持有人可以是同一主体,也可以是两个相互独立的主体。根据自身状况,上市许可持有人可以自行生产,也可以委托其他生产企业进行生产。
如果委托生产,上市许可持有人依法对药品的安全性、有效性和质量可控性负全责,生产企业则依照委托生产合同的规定就药品质量对上市许可持有人负责。
可见,上市许可持有人制度与现行药品注册许可制度的最大区别不仅在于获得药品批准文件的主体由药品生产企业扩大到了药品研发机构、科研人员,而且对药品质量自始至终负责的主体也更为明确,从而有利于确保和提升药品质量。
也就是说,以药品上市许可持有人制度试点为突破口,我国药品注册制度将由上市许可与生产许可的“捆绑制”,向上市许可与生产许可分离的“上市许可持有人制度”转型。
目前,试点药品范围主要包括试点方案实施后批准上市的新药、按新标准批准的仿制药以及试点方案实施前已批准上市的部分药品。不包括麻醉药品、精神药品、医疗用毒性药品、放射性药品、预防用生物制品、血液制品。
据悉,《药品上市许可持有人制度试点方案》(以下简称《试点方案》)自印发之日起,实施至2018年11月4日。
试点工作期间核发的药品批准文号,试点期满后,在药品批准证明文件载明的有效期内继续有效。
试点工作结束后,食品药品监管总局将及时总结试点经验,对于实践证明可行的做法,及时提出修改完善《药品管理法》《药品管理法实施条例》等法律、法规的建议,并修改完善相关部门规章,以便适时在全国范围内针对所有药品品种全面推行药品上市许可持有人制度。
▍165个品种已申报
自上市许可持有人制度试点推行以来,一批药品已经申报成功。
2017年4月20日,原国家食药监总局官网发通知,首个上市许可持有人制度试点品种获批。
具体信息如下:
浙江医药股份有限公司新昌制药厂的苹果酸奈诺沙星原料药及其胶囊剂经国家食品药品监管总局批准取得了药品上市许可持有人制度试点品种,浙江医药股份有限公司新昌制药厂为本品上市许可持有人。
苹果酸奈诺沙星是一种新型的无氟喹诺酮类抗菌药物,是国家食品药品监管总局自药物临床试验数据自查核查以来首个获批的创新药。
截至2016年12月25日,据食药监统计,10个试点省份药品上市许可持有人试点品种申报数量共165。
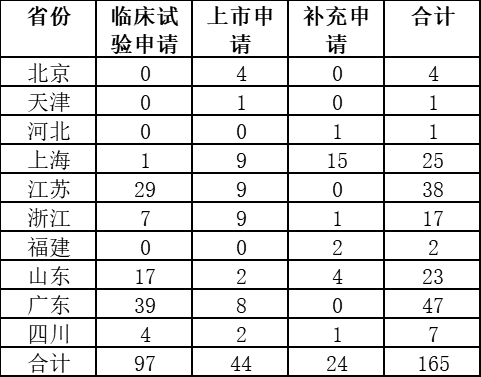
(图表制作:赛柏蓝)
从这一数字可以看出,随着上市许可持有人制度的全国推行,我国新药上市将迎来难得机遇期。
