最新消息,近日,安进生物依洛尤单抗注射液(Evolovumab)在国内的进口上市申请已经审批完毕,推测该产品在国内获批上市。该品种的上市申请于2017年10月获得了CDE承办受理,2017年12月被纳入到优先审评程序,进口审评耗时不足1年,若该药物此次顺利获批,这将是国内首款获批上市的PCSK9单抗抑制剂。

国内即将上市的首款PCSK9单抗抑制剂
Evolovumab 是一种人单克隆免疫球蛋白 G2 (IgG2),针对人前蛋白转化酶枯草溶菌素 kexin 9 型 (PCSK9),能够高效率地降低患者体内的低密度脂蛋白胆固醇(LDL-C),该单抗药物由安进和安斯泰来开发,于2015年8月获得了FDA的上市批准。
2017 年 12 月 1 日,FDA在对安进公司递交的补充生物制剂许可申请进行优先审核后,批准了依洛尤单抗用于已有动脉粥样硬化性心血管疾病成人患者来预防心肌梗死、脑卒中和冠状动脉血运重建,依洛尤单抗由此成为获批此类适应症的首款 PCSK9 抑制剂。
概括来讲,PCSK9单抗抑制剂为对抗LDL-C提供了一种全新的治疗模式。这类药物也因此被视为继他汀类之后降脂药物领域的最大进步,业界对这类药物的表现寄予了厚望。
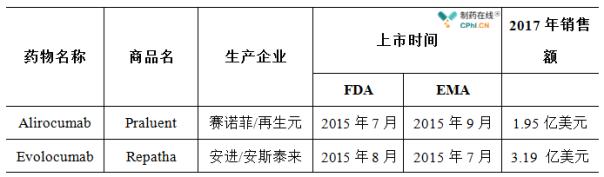
目前全球已有两款PCSK9 单抗上市,除了安进的依洛尤单抗之外,还有Alirocumab (Praluent),该药物是一种全人源IgG1 型单克隆抗体,由赛诺菲和再生元联合开发,于2015 年7 月获得FDA 批准上市。
销售表现远不及预期国内PCSK9抑制剂备战速览
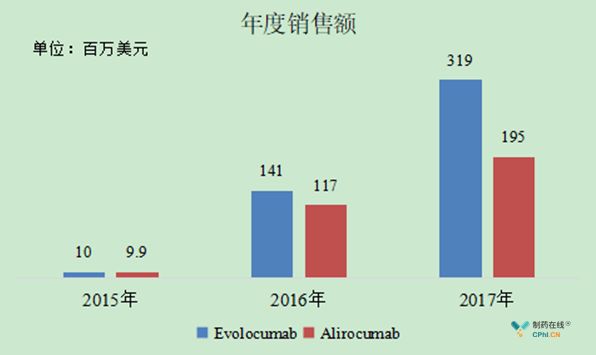
2017年Evolocumab的销售额为3.19亿美元,Alirocumab的销售额仅仅为1.95亿美元。作为被寄予了厚望的潜在重磅炸弹级药物,这种市场表现与预期相差甚远。
IMS曾做出预测,20%血脂异常的美国患者将不再使用他汀类药物,转而使用PCSK9单抗抑制剂,这是此类药物的潜在市场增量空间。RBC Capital Markets分析师的预测则更为直观:PCSK9抑制剂类药物的市场将超过90亿美元,即使是大多数人相对保守的估计,这类药物的年度销售额也将高达30亿美元。
从目前的结果来看,这两款明星药物销售额远不及预期的主要原因之一在于PCSK9单抗的价格,粗略估计,患者使用PCSK9单抗的年度费用是他汀类药物的350倍,昂贵的价格阻碍了这类药物的市场增长。
针对销售低迷的状况,无论是安进生物还是赛诺菲都在就产品本身进行着更多的加码和尝试,包括对给药装置做出的改进以及更多的临床使用益处探索。
有调查结果显示,我国血脂异常的发生率为40.4%,其中高脂血症的发病率超过了30%。目前,在国内调血脂药物市场中,他汀类药物占据了大约90%的市场份额,已上市7款他汀类药物的总体市场规模大约为200亿元,其中的主力产品为阿托伐他汀、辛伐他汀以及瑞舒伐他汀。
相比于欧美人群,在使用大剂量他汀类药物时,国内患者发生肝酶升高和肌病风险等副作用的风险更高,新型降脂类药物在国内拥有着很大的临床和市场需求。从现有降脂类药物的功效来看, PCSK9 单抗抑制剂是他汀类药物之后最有前景的降脂类药物:与他汀类降脂药物相比,PCSK9 单抗抑制剂拥有更加强效的降脂效率以及更加明显的安全性优势,这类药物在国内的临床应用潜力巨大。
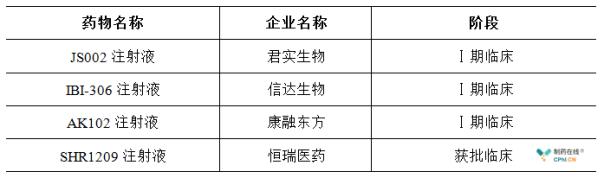
在国内PCSK9单抗抑制剂类的新药开发竞赛中,处于第一梯队的本土制药企业有4家,分别为君实生物、信达生物、康融东方以及恒瑞医药。其中,君实生物JS002注射液、信达生物IBI-306注射液、康融东方AK102注射液均处于Ⅰ期临床试验阶段,恒瑞医药SHR1209 注射液的临床注册申请于本月获得批准,公司将在近期开展临床试验。
除了上述四家制药公司的在研产品之外,加入PCSK9单抗新药开发的本土制药企业还包括了上海嘉和生物、北京天广实、北京智仁美博等。