美国FDA是全球最严苛的药政监管机构之一,一直致力于全面保障美国本土消费者的健康和安全。 随着药品生产、流通和使用的日益全球化,中国作为原药料和制剂出口大国,而美国作为原料药和仿制药制剂的主要进口国,因此对美国本土以外的原料药和仿制药药品生产企业受到的监管越来越严苛;另一方面,全球化药品生产供应链带来不断的挑战,中国国内的制剂企业也在不断创新和发展,持续加大国际化认证和注册布局和投入,试图努力进军美国市场。与此同时FDA也不断调整监管策略,加强对海外工厂的检查和监督,确保消费者可获得安全有效的药品。这种相互推动的贸易发展和有所冲突的监管博弈的冲突在近几年发生了更多的新趋势。
FDA对制药企业的监管行为的后果主要体现在 483 表(现场观察报告)、警告信、进口警报等方式。首先,我们先大致了解一下这几种最常见的监管方式的基本情况:
★483表
483表即现场观察报告"Inspectional Observations",这份表格编号是"Form 483",因此习惯称之为483表。 FDA检查官在检查(inspection)中,如有任何观察项(Observation),则会当场出具FDA 483表。483表就是FDA 检查官根据cGMP 规范和相关技术指南的要求,对医药企业的质量体系进行现场检查过程中所发现的不符合cGMP 规范要求所列出的缺陷问题。483表一般是不公开的,只有企业自己收到。除非FDA认为有必要,会在FDA官网公开部分483表。
★警告信
FDA 警告信是用以通知被监管者在FDA的检查中或调查中有被记录在案的违法事实的一种信件。一般情况下,收到483表后,企业要确保在15个工作日内进行书面回复;如果回复被FDA认可,则不会上升为警告信,如果FDA认为企业对483表的回复不充分,FDA会开警告信。警告信是公开在FDA官网上面的,所有人都可以看到。
★进口警报
进口警报也称为进口禁令,如果进口美国的产品出现违反FDA法律条款时,FDA会发出进口警报通知FDA当地职员和公众,以说明FDA有充足的证据对产品施行无检测扣押(DWPE)。这些违反行为可能与产品本身、生产商、运输和或其他信息有关。
进口警报中有两种形式,即 DWPE 或 DWPE with surveillance,DWPE,Detention Without Physical Examination, 即为无需查验分析即可被直接扣押。列入进口警报黑名单上的药品,无需查验分析即可被直接扣押,这样肯定会对企业造成声誉和经济上的损失;DWPE with surveillance即DWPE并增加部分监督监管活动。
进口警告编号是由FDA发布的,前两位数字代表产品的行业代码。例如,任何与人用药品有关的进口警告都是由66开头的(如图1),本文重点梳理的主要是66-40,Detention Without Physical Examination of Drugs From Firms Which Have Not Met Drug GMPs,即"自动扣押违反cGMP企业的药品"。
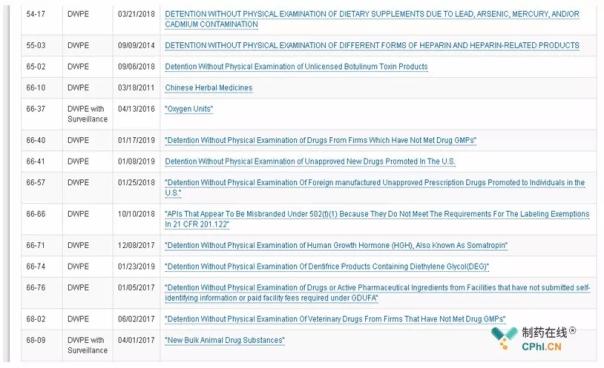
图1 FDA进口警报分类表
我们对历年来国内企业收到的进口警报数作了简单的统计(见图2),十年间,进口警报数略有起伏,但总体是上扬的趋势。从图2可以看出明显的趋势:在2015年以前,尽管FDA也对中国输入美国市场的药品采取一定数量的进口警报措施,但是总体处于较低水平,而且波动不大。自2016年开始,在连续三年中FDA对中国药品生产企业采取了更加严格的监管措施,甚至对很多企业检查后不等483表的回复情况,直接签发进口警告。这些信息都透漏出,中美政治局势和贸易战对药品国际贸易的显著影响。
FDA进口警报与警告信签发关系并非永远完全一致的关系。一般情况下,发出进口警报前会先发出警告信,但也存在严重违规的情况下或其它原因直接发出进口警报。

图2 历年来国内企业进口警报数
在2018年,FDA66-40进口警报黑名单中共有国内18家企业上榜(详见表1),其中多家收到了FDA的警告信,如宜城市共同药业有限公司、云南丽江映华、佛山市晋雄科技、吉林省舒兰合成药业股份有限公司、四川菲德力制药、河南利华制药有限公司、杭州嘉日用品有限公司、浙江华海药业等。
表1 2018年国内企业进口警报情况表

从上面信息可以看出,随着中美贸易战的持续加剧,中国药品企业想把产品销售到美国市场会遇到越来越大的困难和阻力。另外一个方面,也提醒中国境内企业,要持续加大技术研发力度和提升合规水平,努力在市场竞争中争取优势资源和位置,这样才可以在日益激烈的竞争中,处于优势地位。
