它曾一度收获诺贝尔奖的荣光,也曾被认为是医药行业的一大泡沫。从12年前的诺奖折桂,到今日的首款新药获批,RNAi技术走过了一条艰辛而曲折的发展道路。欲戴其冠,必承其重。在今天的这篇文章里,我们也将与各位读者一道,回顾人类历史上首款RNAi疗法诞生的故事。
意外而至的诺贝尔奖
2006年10月2日凌晨2:30分,斯坦福大学的Andrew Fire教授接到了一通来电。电话那头,一个略带口音的声音向他表示祝贺。诺贝尔奖委员会决定,Fire教授与马萨诸塞大学的Craig Mello教授一道,将共享2006年的诺贝尔生理学或医学奖。
和许多诺贝尔奖得主一样,Fire教授的第一反应是“非常惊讶”,甚至怀疑对方拨错了号码。他的惊讶并不是没有理由。自上世纪80年代起,诺贝尔生理学或医学奖得主的平均年龄都超过了60岁。但他当年只有47岁,Mello教授更是只有45岁。而且,距离他们合作发表的重要论文问世,也只有短短8年的时间。这一切都来得太快,太不真实了。
许多生物学家指出,这些不寻常的数字,恰好反映了他们的工作有多么不寻常。“他们的发现是一个再明显不过的诺贝尔奖,”诺奖得主Thomas Cech教授说道:“它在所有人的诺奖候选名单上。”很少有人质疑他们的贡献,这些荣誉实至名归。
这个不寻常的发现,就是RNA干扰(RNA interference,简写RNAi)机制的发现。这是一种通过双链RNA对基因进行沉默的方法。诺贝尔奖委员会称,这是控制遗传信息流的一个根本性机制,在植物、动物、人类中均存在,在生物技术与医学领域有着广阔的应用前景。
什么是RNAi?
有趣的是,这两位科学家并不是首批发现RNAi现象的人。在他们之前,植物学家们就观察到了一些难以解释的现象。1990年,两名植物学家报道了一个令他们大感意外的发现——在矮牵牛花中,查尔酮合成酶(chalcone synthase)是一种在花青素合成通路里起到限速作用的酶。研究人员们猜测,如果提高这种酶的表达量,就能加速花青素的合成,让矮牵牛花的颜色变得更深。
但实验结果与他们的预期截然相反。在过量表达查尔酮合成酶后,矮牵牛花的颜色非但没有变深,反而还变浅了!看着眼前的白色花朵,植物学家们感到无比困惑。后续的研究发现,经过改造的矮牵牛花里头,查尔酮合成酶的含量竟要比野生型低上50倍。这也让研究人员们猜测,从体外引入RNA,会对具有同源序列的基因产生“沉默”。
尽管这些植物学家做出了重要的观察,并提出了潜在的作用机制,但他们却一直没有把这个发现转化为实际应用的技术。这也正是Fire教授与Mello教授的贡献所在。在线虫里,他们发现,只有注射与基因序列一致,或是高度接近的双链RNA,才能有效地对基因产生沉默。这原本可能是生物体的抗病毒机制,却在演化的长河中被用做调控自身基因的手段。而两位科学家的这一发现,也让我们能够用极为简便的方法,对生物的基因进行调控。

▲RNAi的作用机制,让人们看到了实际应用的潜力(图片来源:Copyright © The Nobel Committee for Physiology or Medicine. Illustration: Annika Rohl)
可以说,这项突破性的技术,打开了一扇通往新天地的大门。这一创新的工具得到了许多生物实验室的青睐,也加速了生物学的发展。更重要的是,它让我们看到了通过“基因沉默”治疗疾病的希望。正如诺贝尔奖官方新闻稿中所说的那样,“RNA干扰已经在基础科研中得到了广泛的应用,能用以研究基因的功能。它还有望在未来带来全新的疗法。”
“我相信这个技术会在未来的10年里,在抗癌疗法领域得到非常广泛的应用。”时任冷泉港实验室主席,美国科学院院士Bruce Stillman博士说道。
热情与现实
人们的乐观并不是没有理由:在诺贝尔奖颁发的5年前,我们就完成了人类基因组草图的测序工作。许多研究人员早就开始在哺乳动物细胞里尝试应用RNAi,生物技术公司如雨后春笋般相继问世,争当第一款RNAi新药的发明人。
这背后的逻辑也很容易理解。许多疾病是由于致病蛋白的出现所导致,而常规小分子药物的作用机理,正是结合这些蛋白,抑制其功能。使用RNAi技术则有望抑制它们的表达,将这些致病蛋白扼杀在萌芽之中。由于双链RNA非常容易合成,倘若这一治疗思路能够成功,人们就不再需要繁琐的药物筛选工作,还能规避致病蛋白的“无成药性”难题。因此,生物医药行业对RNAi疗法有着极为高涨的研发热情,一些知名医药公司也开始涉足其中。整个领域充满了热火朝天的干劲,首款RNAi疗法的问世似乎就在眼前。
但在激情褪去后,问题才逐渐浮现出来。其中,研究人员们无法解决的一大难题,在于如何仅在需要的细胞里启动RNAi的流程。更糟糕的是,在泛起的泡沫中,许多人误将高估值当作是成功的保障,一系列疗法仅仅在实验室中做了初步的验证,就匆忙地进入到人体试验。
“早期的许多临床试验非常不明智,许多人为了抢第一才做临床试验,”斯坦福大学的基因疗法专家Mark Kay教授说道:“大部分尚具有理性,同时还了解这一领域的人,都知道这些试验不会成功。”
从一开始就被埋下的灾难种子,很快就结出了恶果。不久后,一些研究中的RNAi疗法在人体里展现出了意料之外,却又在情理之中的危险副作用。由于无法递送到人体内的正确细胞,这些疗法要么没有效果,要么反而对人体有害。
整个RNAi领域瞬间跌入到了谷底,包括罗氏、辉瑞、默沙东在内的诸多生物医药公司纷纷决定退场。2014年,默沙东将旗下的RNAi技术公司Sirna公司折价出售。而购买它的,则是一家名为Alnylam的生物技术公司。
最亮的星
Alnylam成立于2002年,恰好位于RNAi从科学突破(1998年)到摘获诺贝尔奖(2006)的中点。它的名字有些难念,背后却有着有趣的故事——它由“Alnilam”一词衍生而来,中文名是“参宿二”,指的是夜空中距离我们2000光年外的猎户座腰带中点。
如同漫天群星一般,在10多年前,到处都能看到研发RNAi技术的新锐公司,Alnylam看起来与它们没有什么不同。但在RNAi疗法跌入低谷时,Alnylam却是少数留存下来的幸运儿。这并不代表它未曾经历过阵痛。在Alnylam的公司官网上写道,其成立早期也曾遇到过许多挑战:合作伙伴的离去、外界对于技术的丧失信心,都给Alnylam带来了不小的打击。只有在公司内部,才能看到将RNAi疗法变成现实的信念与乐观。

▲这篇论文彻底改变了RNAi疗法的进程(图片来源:《Molecular Therapy》官网截图)
当然,无数案例证明,仅凭信念与乐观是不够的。真正推动Alnylam向前进展的,是其在RNAi疗法的“至暗时刻”发明的一项关键技术。2010年,这家公司发表了一篇足以影响整个RNAi疗法领域的论文——他们发现,利用基于配体的技术,人们终于能对RNAi疗法进行靶向递送。横亘在科学家们前进道路上的最大阻碍被移除了。在他们面前,是通往首款RNAi疗法的康庄大道。
首款RNAi疗法
找到解决问题的关键后,Alnylam迅速建立起了一系列研发管线,针对多种罕见的遗传疾病。其中,其领先的RNAi疗法patisiran所治疗的是一种叫做hATTR淀粉样变性的疾病。这种疾病的根源在于编码甲状腺素运载蛋白的基因发生突变,导致淀粉样蛋白质在人体内的异常积累,对器官和组织造成损伤。这是一种严重而致命的罕见病,患者从症状发作起,预期寿命只有2年-15年。
而patisiran则能发挥RNAi对基因的“沉默”效果。通过抑制特定mRNA的表达,这款疗法能有效阻止变异甲状腺素运载蛋白的生成,清除组织里的淀粉样蛋白沉积,恢复组织功能。
2017年9月,Alnylam与其合作伙伴赛诺菲一道,公布了patisiran在3期临床试验中的积极顶线结果。研究表明,这款新药抵达了主要临床终点,以及所有的次要临床终点。在18个月的节点上,与安慰剂相比,patisiran显著减少了患者的神经学病变,提高了他们的生活质量。
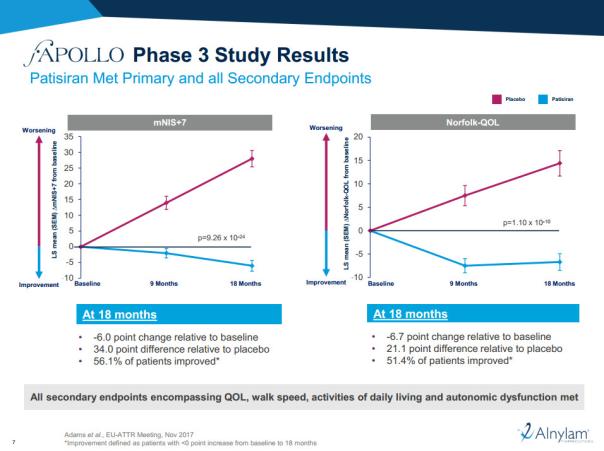
▲这款RNAi疗法在疾病的治疗中取得了出色的成果(图片来源:Alnylam公司官网截图)
2个月后,Alnylam递交了滚动上市申请,以缩短上市所需要的时间。美国FDA也同样授予patisiran突破性疗法认定和孤儿药资格,加速它的问世。8月3日,英国授予patisiran“早期获取”(Early Access)资格,允许患者在这款疗法正式问世前,就能得到治疗。而在今日,人类终于迎来了首款RNAi疗法的获批。
后记
熟悉新药研发的读者朋友都知道,一项突破性的发现,哪怕是自带诺贝尔奖的光环,也未必能带来一款新疗法。即便最终能从实验室出发,来到患者的病床前,这些新疗法也往往会经历漫长的研发之旅。过去的单克隆抗体是这样的例子,如今的RNAi疗法也是这样的例子。
而或许只有那些最勇敢的战士,才能从一片质疑的荆棘中,开辟出一条造福患者的道路。正如Alnylam的官网上所说的那样:对于那些说“不可能、不实际、不现实”的人,我们的回应是“接受挑战”。在本文的最后,我们也向这些挑战不可能的勇者致以崇高敬意。
参考资料:
[1] 2 American ‘Worm People’ Win Nobel for RNA Work. Retrieved August 6, 2018, from https://www.nytimes.com/2006/10/03/science/03nobel.html
[2] Andrew Fire shares Nobel Prize for discovering how RNA can switch off genes. Retrieved August 6, 2018, from https://news.stanford.edu/news/2006/october4/nobel-100206.html
[3] When a Nobel Prize brings a shower of hype: the roller coaster ride of RNAi. Retrieved August 6, 2018, from https://www.statnews.com/2016/09/29/nobel-prize-rnai-biotech/
[4] Average Age for for Nobel Laureates in Physiology or Medicine. Retrieved August 6, 2018, from https://www.nobelprize.org/nobel_prizes/lists/laureates_ages/medicine_ages.html
[5] Sen and Blau (2006). A brief history of RNAi: the silence of the genes. The FASEB Journal. https://doi.org/10.1096/fj.06-6014rev
[6] Suhr et al., (2015). Efficacy and safety of patisiran for familial amyloidotic polyneuropathy: a phase II multi-dose study. Orphanet Journal of Rare Diseases. https://doi.org/10.1186/s13023-015-0326-6
[7] Akinc et al., (2010). Targeted delivery of RNAi therapeutics with endogenous and exogenous ligand-based mechanisms. Molecular Therapy. https://doi.org/10.1038/mt.2010.85
[8] Alnylam and Sanofi Report Positive Topline Results from APOLLO Phase 3 Study of Patisiran in Hereditary ATTR (hATTR) Amyloidosis Patients with Polyneuropathy. Retrieved August 8, 2018, from http://investors.alnylam.com/news-releases/news-release-details/alnylam-and-sanofi-report-positive-topline-results-apollo-phase
[9] "Press Release: The 2006 Nobel Prize in Physiology or Medicine". Nobelprize.org. Nobel Media AB 2014. Retrieved August 8, 2018, from http://www.nobelprize.org/nobel_prizes/medicine/laureates/2006/press.html
