1类化药批准临床概况
2018年7月,共有13个申报临床的中国1类化药新药获得了临床试验批件即将开始临床一期试验,其中6个是特殊审批品种。抗肿瘤药物4个,感染类药物3个,神经系统2个,内分泌和代谢类2个,心脑血管类2个,具体信息如下:

1ICP-192
ICP-192由诺诚健华子公司天诚医药研制的化药1类创新药,它已获得国家药品监督管理局批准开展针对胃癌等实体瘤的临床试验,这是诺诚健华在不到一年时间里第三个候选化合物获批进入临床阶段。
2CS3006
CS3006由基石药业(苏州)有限公司研发,是丝裂原活化蛋白激酶激酶1/2 (MEK1/2)抑制剂,用于治疗实体瘤。RAS-RAF-MEK-ERK信号转导途径是在大多数细胞中发现的最基本的细胞内信号传导途径之一,并且负责调节关键的细胞活动,例如细胞生长、增殖、存活和凋亡。MEK1和MEK2是丝氨酸/苏氨酸蛋白激酶,其作用于RAS和RAF的下游以激活ERK。MEK的抑制可以影响肿瘤细胞的存活、增殖和分化。 目前,两种MEK抑制剂已在全球获得批准和销售:诺华公司的Mekinist® (trametinib)和罗氏公司的Cotellic® (cobimetinib)。目前中国1类MEK1/2抑制剂有4个,均处于临床一期,具体情况如下:
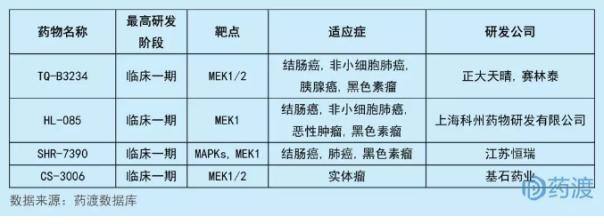
3KL280006
KL280006注射液为四川科伦药业股份有限公司的子公司四川科伦博泰生物医药股份有限公司研发的选择性外周κ阿片受体激动剂,实现有效镇痛的同时,能避免中枢镇痛类药物的不良反应,拟用于急性疼痛(如术后疼痛)的治疗。非临床研究数据证实 KL280006 注射液作用机制明确,对外周κ受体具有高亲和性和高选择性,不易透过血脑屏障,镇痛效果确切,兼具良好的安全性和耐受性,无心脏、呼吸及中枢神经系统等不良反应。
4MAX-40279-01
MAX-40279-01由广州再极医药科技有限公司研发,拟用于治疗急性骨髓性白血病(AML)。2018年4月,中国食品药品监督管理总局受理本品的临床试验申请(化药1类)。
2018年,MAX-40279-01被美国FDA认证为治疗急性骨髓性白血病(AML)的孤儿药。Max-40279-01通过对FLT3和FGFR的双重强烈抑制和较高的骨髓血药浓度,有效克服当前临床应用药物的骨髓FGF通路激活的耐药性。目前尚无除MAX-40279-01之外的FLT3、FGFR双靶点抑制剂上市或进入临床。
5盐酸领克尼斯
LH-031(盐酸领克尼斯)目前处于临床二期,用于治疗肝癌和肺癌,正在国际进行临床试验。本品最初由德国4SC公司研发,2016年5月,广州领晟从4SC获得LH-031在中国地区的独家开发和销售权益。2018年4月获中国食品药品监督管理总局受理,并于2018年7月获得临床试验批件。
LH-031(盐酸领克尼斯)是一种新靶点的抗肿瘤小分子药物。是一种人驱动蛋白(KIF11/EG5)抑制剂,通过抑制EG5从而抑制肿瘤细胞的有丝分裂。LH-031属于微管类药物的新一代品种(第一代品种为紫杉醇),效果优于紫杉醇类,且为靶向药物,不具有细胞毒性。有望广泛应用于多种实体肿瘤,以及血液/淋巴癌。目前在患者的临床试验中已有效果的体现。
6TPN102
TPN102由中国科学院上海药物研究所、苏州旺山旺水生物医药有限公司和上海特化医药科技有限公司研发,拟用于治疗癫痫。2018年4月,本品的临床试验申请(化药1类)获CFDA受理,且于2018年7月获批。国内同靶点的1类新药有4个,具体情况如下表:
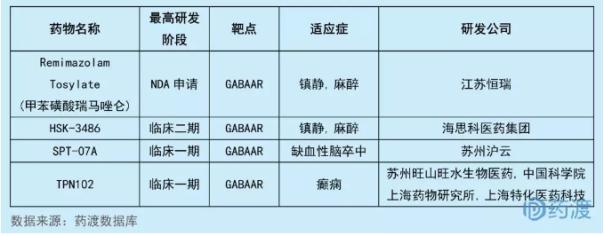
7YL-90148
YL-90148由上海璎黎药业有限公司研发,拟用于治疗痛风和高尿酸血症。YL-90148是继YY-20394、YL-10069之后上海璎黎药业推出的第3个1类化药,2018年3月中国食品药品监督管理总局受理本品的临床试验申请(化药1类),2018年7月获得临床试验批件。关于YL-90148目前没有更多信息披露。
8万格列净
万格列净是由SironaBiochem研发的一个SGLT2抑制剂,拟用于治疗2型糖尿病,2014年1月,其在中国境内(不包括港澳台地区)的研发和商业化权利授权给万邦医药(复星医药控股子公司)。2018年1月,江苏万邦生化医药集团有限责任公司向CFDA提交该化合物的临床试验申请(化药1类)。2018年7月,万格列净获CFDA批准进行临床试验。国内同靶点的1类新药有6个,具体情况如下表:
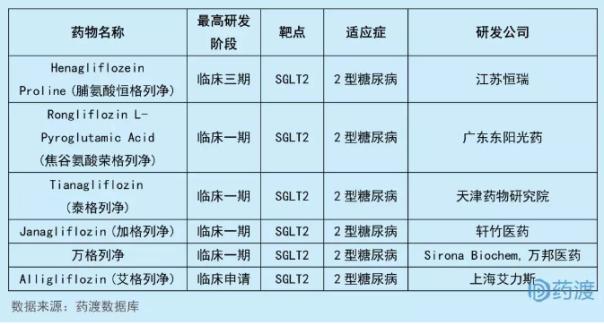
9SY-009
SY-009由亚宝药业集团股份有限公司和礼来联合研发的一种SGLT-1抑制剂,用于降低餐后葡萄糖的吸收,拟用于治疗2型糖尿病。2018年2月中国食品药品监督管理总局受理亚宝药业提交的临床试验申请(化药1类),2018年7月获得临床试验批件。另有靶向SGLT-1的中国1类化药也是亚宝药业和礼来研发的SY-008,目前在进行临床一期试验。
10RMX2001
Delpazolid (LCB01-0371;RMX-2001)由韩国乐高化工生物科学株式会社和海和生物研发的第二代恶唑烷酮类小分子抗生素。目前处于临床二期,用于治疗肺结核。Delpazolid已被FDA授予孤儿药资格、合格传染病产品资格和快速通道资格。
2018年2月中国食品药品监督管理总局受理了由诺迈西(上海)医药科技有限公司提交的RMX2001的临床试验申请(化药1类),并于2018年7月获得临床批件。2018年3月,上海海和药物研究开发有限公司和诺迈西(上海)医药科技有限公司合并为海和生物制药有限公司。
11SY-007
SY-007是一种治疗脑卒中的磷酸酯酶与张力蛋白同源物抑制剂,该化合物最初由Primary Peptides研发,2015年授权给亚宝药业。SY-007为一种新型干扰肽,为脑卒中患者提供神经保护作用, 降低脑卒中患者的缺血性脑损伤程度。
12MRX-4
Contezolidacefosamil (MRX-4)是由盟科药业研发的新一代噁唑烷酮类抗生素,是一种专有的水溶性的contezolid前药,目前处于临床一期,用于治疗多重耐药的革兰氏阳性菌包括耐甲氧西林金黄色葡萄球菌(MRSA)和耐万古霉素肠球菌(VRE)。2018年1月,CDE受理了上海盟科药业有限公司提交的MRX-4及注射用MRX-4的临床试验申请(化药1类),2018年7月获得了临床试验批件。Contezolid acefosamil (MRX-4)是一种单胺氧化酶A抑制剂,目前MAOA抑制剂中国1类化药有2个,具体情况如下:
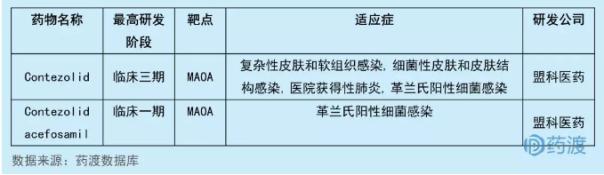
13WX-081
WX-081是一种ATP合酶复合体抑制剂,拟用于治疗耐药性结核病。2017年4月,辰欣药业向中国食品药品监督管理总局(CFDA)提交临床试验申请(化药1类),2018年7月获得临床试验批件。
1类生物药批准临床概况
2018年7月,共有10个中国1类生物药获得临床试验批件即将开始临床一期试验,其中4个是特殊审批品种。抗癌药物一共有8个,皮肤病药物和抗感染药物各1个,具体信息如下:

1重组人源化抗PD-1单抗注射液(山东新时代药业)
山东新时代药业(鲁南药业集团的成员公司)开发的重组人源化抗PD-1单抗可用于多种实体瘤的治疗。2014年9月上市的程序性死亡受体1 (PD-1)阻断剂Keytruda®成为美国首个“广谱抗癌药”,在多种癌症里面都得到了应用,可以很好的控制癌症的进程。这可以说是肿瘤治疗史无前例的开创性突破。目前靶向PD-1的中国1类生物药有15个,具体情况如下:

2CS-1003
CS-1003是基石药业通过杂交瘤技术平台开发的一种的人源化IgG4型单克隆抗体,靶向于程序性死亡受体1 (PD-1),正在进行用于治疗实体瘤的临床一期试验。
目前,全球范围共有两款获批的 IgG4 型 PD-1单抗,分别是百时美施贵宝的Opdivo® (nivolumab)和默沙东的 Keytruda® (pembrolizumab),其中Opdivo® 已于2018年6月在中国获批上市。
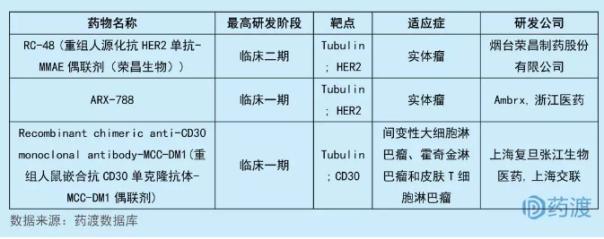
3注射用重组人鼠嵌合抗CD30单抗-MCC-DM1偶联剂
上海医药集团股份有限公司全资子公司上海交联药物研发有限公司与上海复旦张江生物医药股份有限公司联合开发的注射用重组人鼠嵌合抗CD30单克隆抗体-MCC-DM1偶联剂。该药物是新型人用重组单克隆抗体制品,拟用于间变性大细胞淋巴瘤、霍奇金淋巴瘤和皮肤T细胞淋巴瘤。注射用重组人鼠嵌合抗 CD30 单克隆抗体-MCC-DM1 偶联剂靶向于CD30和Tubulin,目前靶向CD30的中国1类生物药仅该药物一个,而以Tubulin为靶向的中国1类生物药有3个,具体情况见下表:
4重组人源化抗PD-1单抗注射液(神州细胞工程)
神州细胞工程开发的重组人源化抗PD-1单克隆抗体已向中国食品药品监督管理局(CFDA)药品审评中心递交了新药临床试验(IND)申请(治疗用生物制品1类),并于2018年3月获得受理,2018年7月获得临床批件。
5抗人CD19T细胞注射液
上海恒润达生生物科技开发的CD19-CART是一种嵌合抗原受体(CAR) T细胞疗法,由抗αCD19-TCRζ-CD28和αCD19-TCRζ-CD137 CAR-T细胞等量混合而成。该产品目前处于临床一/二期研究阶段,用于治疗急性淋巴细胞白血病、慢性淋巴细胞白血病以及非霍奇金淋巴瘤。CAR-T是一种高效、先进的细胞免疫疗法,已在白血病、淋巴瘤、多发性骨髓瘤的治疗中展现出惊人的效果。CAR-T最成功的案例是以CD19为靶点针对B细胞肿瘤的一系列临床试验。目前靶向CD19的中国1类生物药有14个,具体情况如下:

6BDB-001
BDB-001是舒泰神药业开发的一种单克隆抗体药物,用于治疗中重度化脓性汗腺炎(HS)。BDB-001针对HS致病机理,通过阻断C5a可以有效控制炎症反应,从而控制HS相关疾病症状。
7重组抗PD-L1全人单克隆抗体(上海复宏汉霖)
上海复星医药(集团)股份有限公司控股子公司上海复宏汉霖生物技术股份有限公司及上海复宏汉霖生物制药有限公司开发的重组抗 PD-L1 全人单克隆抗体(研发代码:HLX-20)目前在澳大利亚开展临床一期试验,用于治疗实体瘤。目前,全球上市的重组抗 PD-L1 全人单克隆抗体注射液有罗氏的Tecentriq® (Atezolizumab)、默克和辉瑞联合开发的 Bavencio® (Avelumab)、阿斯利康的 Imfinzi® (Durvalumab);中国境内(不包括港澳台地区)尚无已上市的重组抗 PD-L1 全人单克隆抗体注射液。
8重组全人源抗肿瘤坏死因子受体超家族成员4(OX40)单克隆抗体
信达生物开发的重组全人源抗肿瘤坏死因子受体超家族成员4 (OX40)单克隆抗体(研发代码:IBI101)是目前第一个在中国批准用于临床试验的OX40单克隆抗体。作为抗肿瘤免疫治疗领域重要靶点之一,OX40单克隆抗体的研发进展一直备受关注。IBI101作用机制明确,能显著增强效应T细胞的活化,并介导调节性T细胞的清除,从而起到抑制肿瘤细胞生长的作用。
9注射用培干扰素α1b

