Ultragenyx公司罕见病药物Crysvita(burosumab)于2018年4月获得美国FDA批准,用于1岁及以上儿童和成年人X连锁低磷血症(XLH)的治疗。此次批准,使Crysvita成为首个治疗XLH的药物。在批准Crysvita的同时,FDA奖励Ultragenyx公司一张罕见儿科疾病优先审评券(PRV),以奖励其在罕见儿科疾病新药研发方面做出的突出贡献。
近日,Ultragenyx公司的合作伙伴协和发酵麒麟(Kyowa Hakko Kirin)透露,双方已将这张罕见儿科疾病PRV以8060万美元的价格出售,具体受让方未披露。这也是Ultragenyx公司第二次出售PRV。去年11月,该公司酶替代疗法Mepsevii获得美国FDA批准时也获得了一张罕见儿科疾病PRV,但这张券随后在12月中旬以1.3亿美元的价格出售给了瑞士制药巨头诺华公司。
此次8060万美元的价格,也创下了PRV市场交易价的新低,并且已经接近首张PRV的交易价。2014年7月,BioMarin公司将一张PRV以6700万美元的价格出售给了赛诺菲,由此创下了买卖PRV的先河。
PRV是美国FDA为了鼓励制药企业开发针对某些热带疾病、罕见病、物质威胁医疗对策的药物所推行的一种福利制度。凡是按照疾病清单成功开发出相关药物的制药商均可获得一张PRV。这张PRV可由药企自己使用,也可转手卖给其他制药公司,用于不符合优先审评的任何一款药物申请优先审评,可将药品审查周期缩短4个月时间。
最初,由于稀缺性,PRV在买卖市场备受热捧,价格也一路水涨创高,艾伯维在2015年从United Therapeutics手中以3.5亿美元买进一张PRV,创造了PRV交易的天价。但随着PRV颁发数量的逐渐增多,近年来市场上交易价一直在下降。
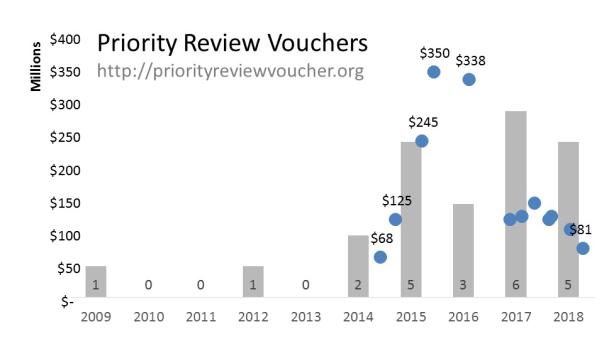
根据新浪医药之前的一篇报道(DIA28:优先审评券(PRV)究竟还能值多少钱?),PRV市场存量的稳步增加,将进一步拉低其市场交易价。
去年,FDA创纪录的颁发了6张PRV。而在今年,截止7月份,FDA就已颁发了5张PRV,最近的一张是今年7月20日抗疟药Krintafel(单剂量他非诺喹)获批时将一张热带病PRV奖励给了葛兰素史克。值得一提的是,葛兰素史克的这张也是FDA迄今为止颁发的第23张PRV。
据统计,这23张PRV中罕见病占到了三分之二。目前,医药行业对罕见病新药研发的热情持续高涨,同时FDA也在努力扩大PRV项目,纳入与化学、生物、辐射威胁、核威胁和新发传染病有关的医疗对策。这也意味着,未来PRV颁发数量将进一步增加,市场交易价会进一步降低。另一方面,FDA已明确表示,不喜欢制药企业将PRV用于医疗需求不是那么紧迫的治疗领域。业界认为,多方因素或将积极推动PRV回归到该项目成立最初时的目的。
以下是截至目前FDA已颁发的23张PRV及相关使用情况。
1、FDA颁发的23张PRV

2、23张PRV的使用情况

(新浪医药编译/newborn)
文章参考来源:
1、The bar lowers yet again for PRV prices, with Kyowa/Ultragenyx selling at $80.6M
2、Priority Review Vouchers
